Content not available in English
 Este texto consolidado es de carácter informativo y no tiene valor jurídico.
Este texto consolidado es de carácter informativo y no tiene valor jurídico.[Disposición derogada]
La Directiva 93/85/CEE del Consejo, de 4 de octubre de 1993, relativa a la lucha contra la necrosis bacteriana de la patata, establece las medidas generales a adoptar en el seno de la Comunidad para la lucha contra este agente nocivo, así como la posibilidad de que los Estados miembros puedan adoptar medidas adicionales más estrictas en caso necesario, siempre que no se obstaculice la circulación de las patatas dentro de la Comunidad, salvo en los casos previstos en el Real Decreto 2071/1993, de 26 de noviembre, relativo a las medidas de protección contra la introducción y difusión en el territorio nacional y de la Comunidad Económica Europea de organismos nocivos para los vegetales o productos vegetales; así como para la exportación y tránsito hacia países terceros.
Teniendo en cuenta que el conocimiento de esta enfermedad y sus métodos de detección han evolucionado significativamente en los últimos años y que la aplicación del régimen fitosanitario comunitario a la Comunidad como un espacio sin fronteras son circunstancias por las que ha sido necesario derogar la Directiva 80/665/CEE del Consejo, de 24 de junio de 1980, relativa a las medidas mínimas que los Estados miembros debían adoptar contra la necrosis bacteriana, se hace preciso adoptar las medidas necesarias contempladas en la Directiva 93/85/CEE del Consejo, de 4 de octubre de 1993.
En consecuencia, mediante esta Orden se traspone al ordenamiento interno dicha Directiva, de acuerdo con la competencia atribuida al Estado por los artículos 149.1.10.ª y 149.1.13.ª de la Constitución Española en materia de comercio exterior y bases y coordinación de la planificación general de la actividad económica, así como en ejercicio de la facultad que la disposición final primera del Real Decreto 2071/1993 atribuye al Ministro de Agricultura, Pesca y Alimentación para su desarrollo.
En su virtud, dispongo:
La presente disposición establece las medidas que deben adoptarse contra «Clavibacter michiganensis» (Smith) Davis et al. ssp. «sepedonicus» (Spieckermann et kottohoff) Davis et al., causante de la necrosis bacteriana de la patata (en lo sucesivo denominado «el organismo»), para:
a) Localizarlo y determinar su distribución.
b) Impedir su aparición y propagación, y
c) En caso de que aparezca, impedir su propagación y combatirlo con el fin de erradicarlo.
1. Se llevarán a cabo sistemáticamente encuestas oficiales relativas al organismo en tubérculos y, cuando corresponda, en plantas de patata («Solanum tuberosum» L.), para confirmar su ausencia.
Para estas encuestas, en el caso de los tubérculos, se tomarán muestras de patatas de siembra y de otro tipo, preferiblemente procedentes de lotes almacenados, que se someterán a pruebas de laboratorio oficiales o realizadas bajo control oficial, según el método dispuesto en el anexo I, para la determinación y el diagnóstico del organismo. Además cuando proceda, podrá realizarse una inspección visual oficial o bajo control oficial de otras muestras que implique el corte de los tubérculos.
En el caso de las plantas deberán realizarse según los métodos apropiados que se determinen y las muestras deberán someterse a pruebas oficiales o bajo control oficial.
2. Los organismos oficiales responsables de cada Comunidad Autónoma, a los que se hace referencia en el artículo 11.2, b), del Real Decreto 2071/1993, deberán elaborar anualmente un programa en el que se determine el número, origen, estrato y calendario de toma de muestras, basándose en principios científicos y estadísticos sólidos, y en la biología del organismo, teniendo en cuenta los sistemas particulares de producción de patatas de las diferentes Comunidades Autónomas.
Los detalles se comunicarán anualmente a través del cauce establecido a los demás Estados miembros y a la Comisión de la Comunidad Europea, con objeto de garantizar niveles de protección comparables entre los Estados miembros para la confirmación de la ausencia del organismo.
3. Los organismos oficiales responsables de las Comunidades Autónomas notificarán los resultados de las encuestas oficiales a que se refiere el apartado 1, a la Dirección General de Sanidad de la Producción Agraria, y ésta a su vez a los demás Estados miembros de la Comunidad y a la Comisión de la Comunidad Europea.
Los detalles de esta notificación serán confidenciales y podrán comunicarse al Comité Fitosanitario Permanente con arreglo al procedimiento comunitario establecido.
Los productores, los almacenes colectivos y los centros de expedición de patatas deberán notificar inmediatamente a los órganos competentes de las Comunidades Autónomas, en que estén situadas sus parcelas o establecimientos, la aparición sospechosa o la presencia confirmada del organismo en tubérculos o plantas que produzcan, almacenen o comercialicen.
1. Cuando los organismos oficiales responsables de las Comunidades Autónomas, tengan conocimiento, a través de las encuestas a que se refiere el apartado 1 del artículo 2 o mediante la notificación a que se refiere el artículo 3, o por cualquier otro medio, de la aparición sospechosa del organismo, éstos adoptarán las medidas oportunas para que se realicen pruebas de laboratorio oficiales o realizadas bajo control oficial con el método a que se refiere el anexo I y en las condiciones establecidas en el punto 1 del anexo II, con el fin de confirmar o desmentir la aparición sospechosa; en el primer caso se aplicará lo dispuesto en el punto 2 del anexo II.
2. Hasta tanto no se haya confirmado ni desmentido la aparición sospechosa con arreglo al apartado 1, en aquellos casos de aparición sospechosa en que:
i) Se hayan observado síntomas visuales de diagnóstico sospechosos, o
ii) Se hayan obtenido resultados positivos con la prueba de inmunofluorescencia con arreglo al anexo I o con otra prueba idónea que se establezca al efecto.
Los órganos competentes de las Comunidades Autónomas adoptarán las siguientes medidas:
a) Prohibir la circulación de todos los lotes o partidas de los que se hayan tomado las muestras, excepto bajo control oficial y siempre que se compruebe que no existe ningún riesgo identificable de propagación del organismo;
b) Tomar medidas para descubrir el origen de la aparición sospechosa;
c) Adoptar medidas cautelares suplementarias adecuadas, que se establecerán, basadas en el nivel de riesgo estimado, para evitar cualquier propagación del organismo. Dichas medidas podrán incluir el control oficial de la circulación de todos los demás tubérculos o plantas dentro o fuera de las instalaciones relacionadas con la aparición sospechosa.
1. En el caso de que las pruebas de laboratorio oficiales o realizadas bajo control oficial con el método establecido en el anexo I confirmen la presencia del organismo en una muestra de tubérculos, plantas o partes de plantas, los organismos oficiales responsables de las Comunidades Autónomas, basándose en principios científicos sólidos, las características biológicas del organismo y los sistemas particulares de producción, comercialización y transformación de cada región:
a) Declararán contaminados los tubérculos, plantas, partidas y/o lotes, así como la maquinaria, vehículos, buques, almacenes o unidades de almacenamiento y cualesquiera objetos, incluido el material de embalaje, de los que proceda la muestra y, en su caso, el lugar o lugares de producción y el campo o los campos donde hayan sido recolectados los tubérculos o las plantas;
b) Determinarán, teniendo en cuenta lo dispuesto en el punto 1 del anexo III, la extensión de la probable contaminación por contacto previo o posterior a la recolección o por relación de producción con la contaminación declarada;
c) Delimitarán una zona basándose en la declaración de la contaminación mencionada en la letra a), la determinación de la extensión de la probable contaminación a que se refiere la letra b) y la posible propagación del organismo, teniendo en cuenta lo dispuesto en el punto 2 del anexo III.
2. Los organismos oficiales responsables de las Comunidades Autónomas notificarán inmediatamente a la Dirección General de Sanidad de la Producción Agraria, y ésta a los demás Estados miembros de la Comunidad y a la Comisión de la Comunidad Europea, de acuerdo con lo dispuesto en el punto 3 del anexo III, cualquier contaminación declarada de conformidad con la letra a) del apartado 1 y los detalles de la zona delimitada de conformidad con la letra c) del apartado 1. Los detalles de esta notificación serán confidenciales.
3. Cuando el Estado español sea mencionado en la notificación de contaminación confirmada de otros Estados miembros, la autoridad competente deberá declarar la contaminación, determinar la extensión de la probable contaminación y delimitar una zona de conformidad con las letras a), b) y c) del apartado 1.
Cuando los tubérculos o plantas hayan sido declarados contaminados, en virtud de la letra a) del apartado 1 del artículo 5, se dispondrá la realización de pruebas conforme a lo dispuesto en el apartado 1 del artículo 4 en las existencias de patatas que tengan relación clonal con las implicadas en la contaminación. Las pruebas se realizarán en tantos tubérculos o plantas como sea necesario para determinar la causa primaria de infección probable y la extensión de la probable contaminación, preferiblemente por orden de riesgo.
A la vista de los resultados de las pruebas, se procederá a una nueva declaración de contaminación, a la determinación de la extensión de la probable contaminación y a la delimitación de una zona, cuando proceda, de conformidad, respectivamente, con las letras a), b) y c) del apartado 1 del artículo 5.
Los órganos competentes de las Comunidades Autónomas adoptarán las siguientes medidas:
a) Prohibir que los tubérculos o plantas declarados contaminados en virtud de la letra a) del apartado 1 del artículo 5 puedan ser plantados y que, bajo control oficial, sean:
Destruidos o
Eliminados de otro modo, por medio de medidas bajo control oficial, de conformidad con el punto 1 del anexo IV, siempre que se compruebe que no existe ningún riesgo identificable de propagación del organismo.
b) Disponer que los tubérculos o plantas que se consideren probablemente contaminados de conformidad con la letra b) del apartado 1 del artículo 5 no puedan ser plantados y, sin perjuicio de los resultados de las pruebas a que se refiere el artículo 6 para las existencias de patata que tengan relación clonal, bajo control oficial sean utilizados o eliminados de manera apropiada como se indica en el punto 2 del anexo IV en condiciones que garanticen la exclusión de cualquier riesgo identificable de propagación del organismo.
c) Disponer que la maquinaria, vehículos, buques, almacenes o unidades de almacenamiento y cualesquiera otros objetos, incluido el material de embalaje, que se declaren contaminados de conformidad con la letra a) del apartado 1 del artículo 5, o se consideren probablemente contaminadas de conformidad con la letra b) del citado artículo, sean destruidos o limpiados y desinfectados aplicando métodos apropiados como los indicados en el punto 3 del anexo IV, que permitan garantizar la exclusión de cualquier riesgo identificable de propagación del organismo. Tras su desinfección, esos objetos ya no se considerarán contaminados.
d) Sin perjuicio de las medidas previstas en los apartados a), b) y c), disponer la aplicación de una serie de medidas definidas en el punto 4 del anexo IV en la zona delimitada de conformidad con la letra c) del apartado 1 del artículo 5.
Los organismos oficiales responsables dispondrán que las patatas de siembra se ajusten a los requisitos establecidos en el Real Decreto 2071/1993 y que procedan directamente de material obtenido de acuerdo con un programa oficialmente aprobado y que haya sido declarado exento del organismo merced a pruebas oficiales o realizadas bajo control oficial según el método establecido en el anexo I.
Las mencionadas pruebas se llevarán a cabo:
a) En las plantas de la selección clonal inicial cuando la contaminación afecta a la producción de patata de siembra.
b) En los demás casos, en las plantas de la selección clonal inicial, en las muestras representativas de patatas de siembra de base o en los materiales de reproducción anteriores.
Queda prohibida la tenencia y manipulación del organismo.
Sin perjuicio de lo dispuesto en el Real Decreto 2071/1993, los órganos competentes de las Comunidades Autónomas podrán autorizar excepciones a las medidas contempladas en los artículos 6, 7 y 9 de la presente disposición para fines experimentales o científicos y para trabajos de selección varietal, siempre que tales excepciones no obstaculicen la lucha contra el organismo ni supongan un riesgo de propagación de éste.
Los órganos competentes de las Comunidades Autónomas podrán adoptar medidas adicionales o más estrictas necesarias para combatir al organismo o impedir su propagación, siempre y cuando se ajusten a lo dispuesto en el Real Decreto 2071/1993.
Las medidas adicionales que se mencionan en el párrafo primero del presente artículo podrán disponer que sólo puedan plantarse patatas de siembra que, de acuerdo con una certificación o una inspección oficial, se ajusten a las normas fitosanitarias. La inspección oficial podrá aplicarse en caso de que los agricultores estén autorizados a utilizar en sus explotaciones patatas de siembra de recolección propia o en otros casos en que se planten patatas de siembra de producción propia.
Los detalles de tales medidas serán notificados a la Dirección General de Sanidad de la Producción Agraria y ésta, a su vez, a los demás Estados miembros y a la Comisión de la Comunidad Europea a través del cauce correspondiente.
Queda derogada la Orden de 28 de febrero de 1986 relativa a la prevención y lucha contra el marchitamiento bacteriano de la patata, en aplicación de la Directiva 80/665/CEE del Consejo de las Comunidades Europeas.
La presente disposición entrará en vigor el día siguiente al de su publicación en el «Boletín Oficial del Estado».
Madrid, 22 de marzo de 1994.
ALBERO SILLA
Ilmos. Sres. Secretario general de Producciones y Mercados Agrarios y Director general de Sanidad de la Producción Agraria.
1. Extracción de cuñas de la parte basal.
1.1 Lávense 200 tubérculos en agua corriente y quítese la epidermis que cubre la parte basal de cada tubérculo mediante una lanceta o un mondapatatas desinfectado de la forma habitual; puede efectuarse la desinfección sumergiendo el mondapatatas en etanol al 70 % y flameándolo.
1.2 Extráiganse cuidadosamente cuñas de tejido cónicas de las partes básales con un cuchillo o un mondapatatas. Procúrese extraer el mínimo posible de tejido vascular excedente. Una vez efectuadas las tomas, deben procesarse las partes básales de los tubérculos en un plazo de 24 horas (véase el punto 3), o bien conservarse a ‒20 °C durante dos semanas como máximo.
2. Examen visual para detectar síntomas de necrosis bacteriana.
Tras la extracción de las partes basales, efectúese un corte transversal de cada tubérculo y obsérvese la presencia de síntomas de necrosis bacteriana.
Comprímanse los tubérculos y obsérvese si se produce salida de tejidos macerados del tejido vascular.
Los primeros síntomas consisten en un ligero aspecto vítreo o traslúcido del tejido, sin ablandamiento, en torno al sistema vascular, en especial cerca de la parte basal. La corona vascular de la parte basal puede tener un color ligeramente más oscuro de lo normal. El primer síntoma claramente detectable consiste en que la corona vascular adquiere una coloración amarillenta y al comprimir suavemente el tubérculo emergen de los vasos unas columnillas de material caseoso. Dicho exudado contiene millones de bacterias. En esta fase, puede producirse un oscurecimiento pardo del tejido vascular. Al principio, estos síntomas pueden limitarse a una parte de la corona, no necesariamente cerca de la parte basal, y pueden extenderse posteriormente a la totalidad de la corona. A medida que la infección progresa, se produce destrucción de tejido vascular; la zona cortical externa puede separarse de la zona cortical interna. En las fases avanzadas de la infección, se producen grietas en la superficie del tubérculo, que suelen tener un color pardo rojizo en los bordes. Los síntomas pueden verse enmascarados por una invasión secundaria fúngica o bacteriana que puede hacer difícil o incluso imposible, diferenciar los síntomas de necrosis bacteriana avanzada de otras necrosis de los tubérculos.
3. Preparación de las muestras para la tinción de Gram, la tinción de inmunofluorescencia (IF) y la prueba de la berenjena.
3.1 Homogeneícense las partes basales hasta conseguir la maceración completa en un diluyente del que se sepa que no es tóxico para el Corynebacterium sepedonicum [por ejemplo, solución fisiológica con tampón de fosfato 0,05 M (PBS) de pH 7,0] a una temperatura inferior a 30 °C; es aconsejable la incorporación de un desfloculante que no sea tóxico y puede ser necesario un agente antiespumante no tóxico (Apéndices 1 y 2). Debe evitarse la maceración excesiva.
3.2 Extráiganse las bacterias del material homogeneizado empleando uno de los siguientes métodos (1):
(1)Un método alternativo de extracción es el descrito por Dinesen, 1984.
A. a) Centrifúguese durante 10 minutos, a 180 g como máximo.
b) Centrifúguese el sobrenadante durante 10 minutos, a 4.000 g como mínimo. Decántese y deséchese el sobrenadante.
B. a) Déjese reposar el macerado durante 30 minutos, a fin de que los restos de tejido se posen. Decántese el sobrenadante sin perturbar el sedimento.
b) Fíltrese el sobrenadante a través de un papel de filtro (Whatman n.º 1) colocado en un filtro de vidrio sinterizado (n.º 2 = 40 ‒ 100 µm) mediante una bomba de agua de vacío.
Recójase el material filtrado en un tubo de centrífuga. Lávese el filtro con solución PBS estéril para obtener un volumen máximo de material filtrado de 35 ml.
c) Centrifúguese el material filtrado durante 20 minutos, a 4.000 g como mínimo.
3.3 Suspéndase el sedimento en tampón de fosfato 0,01 M de pH 7,2 estéril (Apéndice 2), con el fin de obtener un volumen total aproximado de 1 ml. Divídase en dos partes iguales y consérvese una de ellas como referencia, bien por congelación a ‒20 °C (2) o bien por liofilización. Divídase la otra parte en dos mitades, una para la prueba de IF y tinción de Gram y la otra para la prueba de la berenjena.
(2)Existen purebas (Janse y Van de Vaerenberg, 1987) que la congelación podría disminuir la viabilidad del Corynebacterium sepedonicum. Puede superarse este problema mediante suspensión del sedimento en glicerol al 10 %.
3.4 Es imprescindible que todos los controles y muestras positivos en lo que respecta al C. sepedonicum se procesen por separado, a fin de evitar contaminaciones. Esto se aplica a las preparaciones para IF y a las pruebas de la berenjena.
4. Tinción de Gram.
4.1 Prepárense tinciones de Gram para todas las diluciones del material centrifugado (5.2.1) y para cualquier tubérculo cortado (2) que presente aspecto vítreo, reblandecimiento u otros síntomas sospechosos. Las muestras deben tomarse del borde de los tejidos enfermos.
4.2 Prepárense tinciones de Gram de cultivos conocidos de C. sepedonicum y, si fuese posible, de tejidos infectados naturalmente (5.1).
4.3 Determínense las muestras que contienen células grampositivas corineformes típicas. Por lo general, las células de C. sepedonicum miden 0,8-1,2 µm de largo y 0,4-0,6 µm de ancho.
En el Apéndice 3 se describe un procedimiento de tinción adecuado.
Los preparados de infecciones naturales o de cultivos aislados recientemente suelen mostrar un predominio de bacilos cocoides que habitualmente son de menor tamaño que las células de cultivos en agar más antiguos. En la mayor parte de los medios de cultivo, las células de C. sepedonicum son bacilos corineformes pleomorfos y pueden dar una reacción de Gram variable. Las células se presentan aisladas, de a pares con unos «codos» característicos típicos de la división por plegado y, en ocasiones, en grupos irregulares descritos generalmente como empalizadas o caracteres chinos.
5. Método para la prueba de IF.
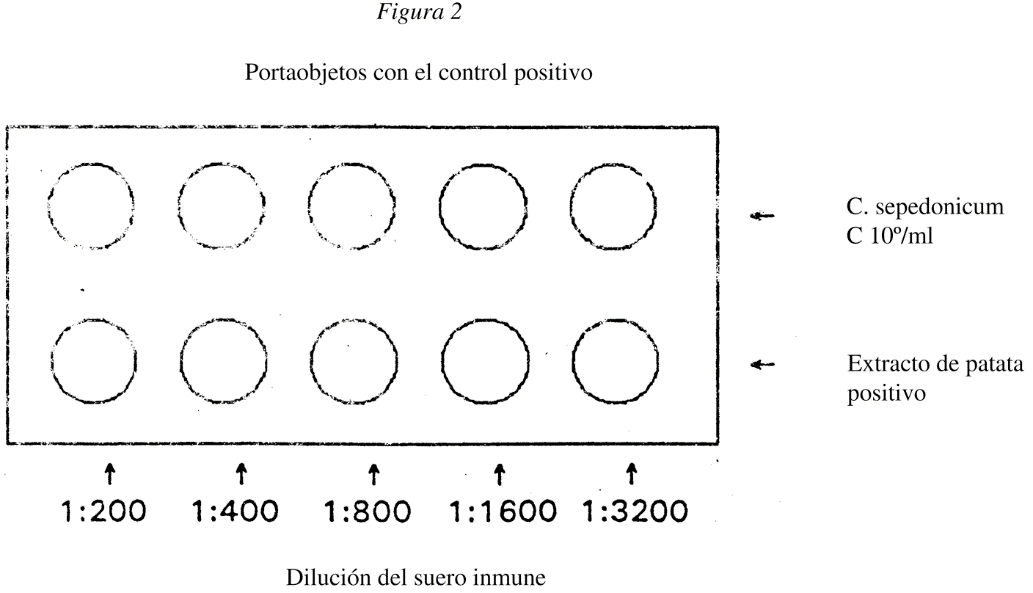
5.1 Utilícese suero inmune contra una cepa conocida de C. sepedonicum ATCC 33113 (NCPPB 2137), o NCPPB 2140. Dicho suero debe tener un título IF no inferior a 1:600. Inclúyase en el portaobjetos de la prueba un control de PBS, a fin de determinar si el conjugado de inmunoglobulina anticonejo con isotiocianato de fluoresceína (FITC) se combina de forma inespecífica con las células bacterianas. Deben utilizarse Corynebacterium sepedonicum [ATCC 33113 (NCPPB 2137), NCPPB 2140] como controles de antígenos homólogos en un portaobjetos separado. De ser posible, deberán utilizarse tejidos infectados de forma natural (conservados mediante liofilización o congelación a - 20 °C) como control similar, en el mismo portaobjetos (véase la figura 2).
5.2 Procedimiento.
5.2.1 Prepárense tres diluciones decimales seriadas (101, 102, 103) del sedimento final en agua destilada (véase la figura 1).
5.2.2 Extráigase con pipeta un volumen estándar medido que sea suficiente para cubrir la ventanita (aprox. 25 µl) de cada una de las diluciones del sedimento o de suspensión de C. sepedonicum (aproximadamente 106 células/ml) y viértase en las ventanitas de un portaobjetos múltiple del tipo representado en la figura 1.
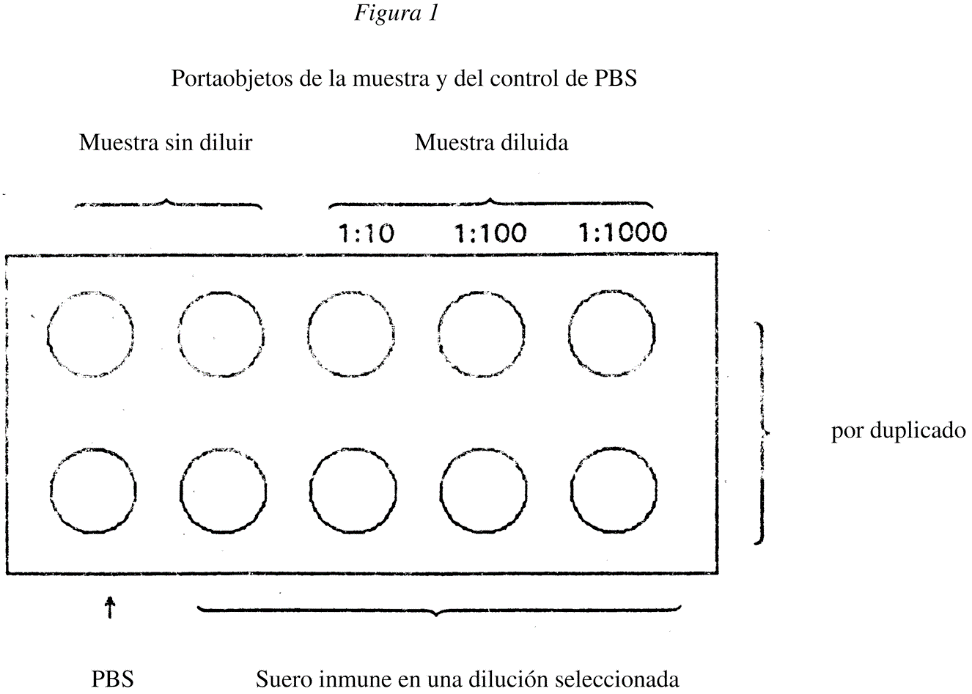
5.2.3 Déjese secar al aire a una temperatura de unos 37 ºC y fíjese con etanol 95 % o mediante flameado.
5.2.4 Cúbranse las ventanitas correspondientes con suero inmune anti-C. sepedonicum a las diluciones recomendadas en PBS 0,01 M de pH 7,2 (Apéndice 2), según se ilustra en la figura 1. (Empléese PBS para el control de FITC). La dilución de trabajo del suero inmune debe ser aproximadamente la mitad del título de IF. En caso de que vayan a incluirse otras diluciones de suero inmune deberán prepararse portaobjetos separados para cada dilución que vaya a emplearse.
5.2.5 Incúbese en una cámara húmeda a temperatura ambiente durante 30 minutos.
5.2.6 Enjuáguese cuidadosamente con PBS 0,01 M de pH 7,2. Lávese durante 5 minutos en PBS 0,01 M de pH 7,2, cambiando la solución tres veces.
5.2.7 Retírese con cuidado el exceso de humedad.
5.2.8 Cúbrase cada ventanita con conjugado FITC en la misma dilución empleada para determinar el título e incúbese en cámara húmeda oscura a temperatura ambiente durante 30 minutos.
5.2.9 Enjuáguese y lávese como se hizo anteriormente.
5.2.10 Aplíquense aproximadamente 5-10 µl de glicerina con tampón de fosfato 0,1 M de pH 7,6 (o un producto similar con un pH que no sea inferior a 7,6) a cada una de las ventanitas y cúbrase con un cubreobjetos (Apéndice 2).
5.2.11 Examínese con un microscopio dotado de una fuente luminosa epifluorescente y de filtros adecuados para trabajar con FITC. Un aumento de 400-1.000 resulta adecuado. Recórranse las ventanitas cultivadas a lo largo de dos diámetros perpendiculares entre sí y alrededor del perímetro de las ventanitas.
Búsquense células fluorescentes en los controles positivos y determínese el título. Búsquense células fluorescentes en la ventanita de control FITC/PBS y, de no hallarse, pásese a las ventanas del material de la prueba. Determínese como mínimo en 10 campos microscópicos el número medio de células fluorescentes morfológicamente típicas por campo, y calcúlese en número por ml de sedimento sin diluir (véase el Apéndice 4).
Existen varios problemas inherentes a la prueba de inmunofluorescencia.
‒ Pueden aparecer en el material centrifugado de patata poblaciones de base de células fluorescentes de morfología atípica y bacterias saprofitas con reacción cruzada cuyo tamaño y morfología sean similares a los del Clavibacter michiganensis ssp. sepedonicus. Ténganse en cuenta únicamente las células fluorescentes de tamaño y morfología típicos.
Dada la posibilidad de reacciones cruzadas, se volverá a efectuar la prueba con un suero inmune diferente en las muestras con resultado positivo de la prueba de inmunofluorescencia.
‒ El límite técnico de detección de este método se sitúa entre 103 y 104 células por ml de material de sedimento, centrifugado sin diluir. Las muestras con recuentos de células IF típicas en el límite de detección suelen dar resultado negativo en lo que respecta al C.m. ssp sepedonicus, pero pueden utilizarse para la prueba de la berenjena.
Se identificará como prueba de inmunofluorescencia negativa toda muestra en la que no se observen células fluorescentes de morfología típica. Se considerará que las muestras «no están contaminadas» por Clavibacter michiganensis ssp. sepedonicus. No será necesario efectuar la prueba de la berenjena.
Se identificará como prueba de inmunofluorescencia positiva toda muestra en la que se observen células fluorescentes de morfología típica. Las muestras identificadas como positivas en la prueba de inmunofluorescencia con ambos sueros inmunes se considerarán «potencialmente contaminadas» por Clavibacter michiganensis ssp. sepedonicus.
Deberá efectuarse la prueba de la berenjena para todas las muestras que se consideren potencialmente contaminadas.
6. Prueba de la berenjena.
Consúltense los pormenores de cultivo en el Apéndice 5.
6.1 Repártase el material centrifugado obtenido según el punto 3.3 entre un mínimo de 25 plantas de berenjena en la fase foliar 3 (Apéndice 5) con arreglo a uno de los métodos que se indican a continuación (6.2, 6.3 o 6.4).
6.2 Inoculación en estrías I.
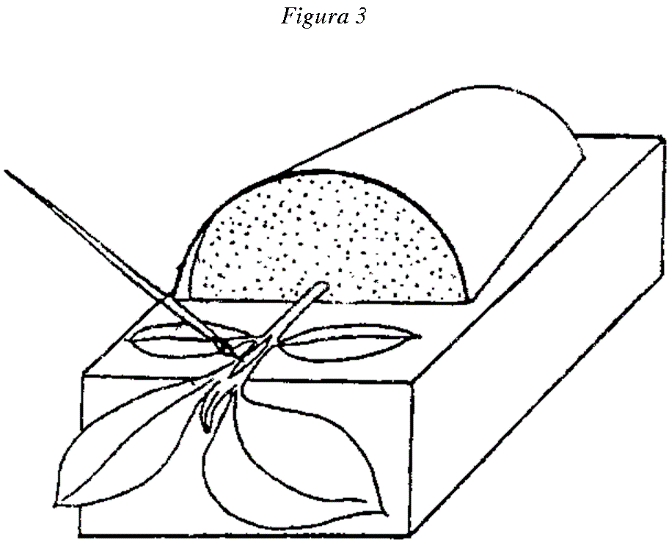
6.2.1 Sujétese el tiesto en posición horizontal [un bloque de poliestireno expandido al que se extrae de una de sus caras un trozo de 5 cm de profundidad × 10 cm de ancho × 15 cm de largo (figura 3) resulta adecuado para un tiesto de 10 cm]. Debe colocarse entre el tallo y el bloque una tira de hoja de aluminio estéril por cada muestra sometida a la prueba. Puede inmovilizarse la planta con una banda de goma alrededor del bloque.
6.2.2 Con una lanceta efectúese un corte longitudinal o ligeramente en diagonal, de 0,5-1,0 cm de largo y de una profundidad aproximada de las tres cuartas partes del diámetro del tallo, entre los cotiledones y la primera hoja.
6.2.3 Manténgase abierta la estría con la punta de la hoja de la lanceta y sitúese en ella el material inoculado mediante un pincel del tipo de delineador de párpados o un pincel fino de pintura artística cargado con el material obtenido por centrifugado. Distribúyase el resto de este material entre las plantas de berenjena.
6.2.4 Séllese el corte con vaselina estéril con una jeringa de 2 ml.
6.3 Inoculación en estrías II.
6.3.1 Sosteniendo la planta entre dos dedos aplíquese con una pipeta una gota (de unos 5-10 µl) del sedimento en suspensión en el tallo situado entre los cotiledones y la primera hoja.
6.3.2 Con una lanceta estéril practíquese una incisión diagonal (a un ángulo de unos 5º), de 1,0 cm de largo y de una profundidad de unos 2/3 del grosor del tallo, comenzando el corte a partir de la gota del sedimento.
6.3.3 Séllese el corte con vaselina estéril con una jeringa.
6.4. Inoculación con jeringa.
6.4.1 Las berenjenas no deben regarse el día anterior a la inoculación para reducir la presión de turgencia.
6.4.2 Inocúlense los tallos de la berenjena justo por encima de los cotiledones utilizando una jeringa provista de aguja hipodérmica (no menos de 23G). Distribúyase el sedimento entre las berenjenas.
6.5 Inocúlense 25 plantas con un cultivo conocido de C. sepedonicum y, cuando sea posible, tejido tuberoso infectado naturalmente (5.1) con el mismo método de inoculación (6.2, 6.3 o 6.4).
6.6 Inocúlense 25 plantas con PBS 0,05 M estéril con el mismo método de inoculación (6.2, 6.3 o 6.4).
6.7 Incúbense las plantas en las condiciones adecuadas (Apéndice 5) durante 40 días. Examínese regularmente si hay síntomas a los 8 días. Cuéntese el número de plantas en que se manifiesten síntomas. La C. sepedonicum produce un marchitamiento de las hojas de las berenjenas, que puede comenzar en forma de flaccidez intervenosa o marginal. El tejido marchito puede aparecer al principio de color verde oscuro o moteado, pero se vuelve más pálido antes de necrosarse. Los marchitamientos intervenosos suelen tener un aspecto graso, como de estar empapados de agua.
El tejido necrosado presenta a veces un margen amarillo brillante. Las plantas no están necesariamente muertas; cuanto más tardan en aparecer los síntomas, tanto mayor es la posibilidad de supervivencia. Las plantas pueden superar la infección. Las berenjenas jóvenes delicadas son mucho más sensibles a las poblaciones bajas de C. sepedonicum que las plantas de más edad, por lo que es necesario utilizar plantas en el estadio foliar 3, o inmediatamente antes del mismo.
Pueden inducir asimismo el marchitamiento las poblaciones de otras bacterias u hongos presentes en el sedimento de tejido tuberoso, entre las que se incluyen la Erwinia carotovora, subespecie carotovora, y la E. carotovora, subespecie atroséptica, la Phoma exigua, variedad foveata, así como grandes poblaciones de bacterias saprofitas. Dichos marchitamientos se pueden distinguir de los causados por la C. sepedonicum, porque se marchitan rápidamente hojas o plantas enteras.
6.8 Prepárese una tinción de Gram (4) para todos los lotes de berenjenas con síntomas, utilizando secciones del tejido foliar y del tallo marchito de las plantas, y aísleselas en medios nutritivos adecuados (7). Desinféctese la superficie de las hojas y tallos de berenjena frotándolos con etanol al 70 %.
6.9 En determinadas circunstancias, en particular cuando las condiciones de crecimiento sean óptimas, puede ocurrir que la C. sepedonicum esté presente como infección latente de las berenjenas, incluso después de un período de incubación de cuarenta días. Dichas infecciones pueden dar lugar a atrofia y falta de vigor de las plantas inoculadas. Si la prueba de IF se considera positiva, puede considerarse necesario hacer nuevas pruebas. Es esencial, por tanto, comparar los índices de crecimiento de todas las plantas de berenjena del grupo experimental con las plantas de control inoculadas con PBS 0,05 M estéril y controlar las condiciones ambientales del invernadero.
A continuación se exponen las recomendaciones para las nuevas pruebas:
6.9.1 Córtense los tallos por encima del sitio de inoculación y quítense las hojas.
6.9.2 Macérense los tallos en una solución de PBS 0,05 M de pH 7,0, como se indica en 3.1 y 3.2.
6.9.3 Utilícese la mitad del sedimento para realizar una tinción de Gram (4) y una prueba de IF (5).
6.9.4 Utilícese la otra mitad para realizar una nueva prueba de la berenjena (6) si la tinción de Gram o la prueba de IF o ambas son positivas. Utilícese un cultivo conocido de C. sepedonicum y controles de PBS 0,05 M estériles. Si no se observan síntomas en la prueba siguiente hay que considerar que la muestra es negativa.
7. Aislamiento de la C. sepedonicum.
Sólo se puede confirmar el diagnóstico si la C. sepedonicum es aislada e identificada como tal (8). Aunque la C. sepedonicum es un organismo delicado, puede aislarse a partir de tejido sintomático. No obstante, puede ser eliminado por las bacterias saprofitas que proliferan rápidamente y, por tanto, no se recomiendan los aislamientos directos a partir del sedimento de tejido tuberoso (3.3). Las berenjenas ofrecen un medio de enriquecimiento selectivo excelente para la proliferación de la C. sepedonicum y facilitan también una prueba confirmatoria excelente de huésped.
Se deben realizar los aislamientos a partir de todos los tubérculos de patata y berenjenas sintomáticos (4 y 6). La maceración de los tallos de berenjena debería realizarse cuando sea necesario, como se expone en 3 y 6.9.
7.1 Siémbrense suspensiones en la superficie de uno de los siguientes medios (las fórmulas están indicadas en el Apéndice 6):
‒ agar de dextrosa nutritivo (solamente para subcultivo),
‒ agar de levadura, peptona, glucosa,
‒ agar nutritivo de levadura, dextrosa,
‒ agar de extracto de levadura, sales minerales.
Incúbese a 21 °C durante 20 días como máximo.
La C. sepedonicum crece lentamente y suele provocar unas colonias punteadas, de color crema, de forma abovedada, en el plazo de diez días.
Siémbrese de nuevo para purificar.
Se mejora el ritmo de crecimiento con subcultivos. Las colonias típicas son de color blanco crema o marfil, redondeadas, lisas, abultadas, abovedadas en forma convexa, mucoso-fluidas, con bordes intactos y normalmente de un diámetro de 1 a 3 mm.
Identificación.
Muchas bacterias grampositivas corineformes, con características de colonia similares a las de C. sepedonicum, pueden aislarse a partir de patatas y berenjenas sanas o enfermas. En dicho contexto, la C. sepedonicum debe identificarse con las siguientes pruebas:
‒ prueba IF (5.1);
‒ prueba de la berenjena;
‒ pruebas fisiológicas y nutricionales (Apéndice 7):
• prueba de la oxidación/fermentación (O/F),
• prueba de la oxidasa,
• crecimiento a 37 °C,
• producción de ureasa,
• hidrólisis de la esculina,
• hidrólisis del almidón,
• tolerancia a una solución de cloruro sódico al 7 %,
• prueba del indol,
• prueba de la catalasa,
• producción de H2S,
• utilización de citrato,
• hidrólisis de la gelatina,
• ácido de: glicerol, lactosa, ramnosa y salicina,
• tinción de Gram.
En todas las pruebas deberá incluirse un control conocido de C. sepedonicum. Las pruebas fisiológicas y nutricionales deberán realizarse utilizando inoculaciones de subcultivos de agar nutritivo. Las comparaciones morfológicas deberán realizarse a partir de cultivos de agar de dextrosa nutritivos.
Para la prueba de la IF, las poblaciones celulares deberán ajustarse a 106 células/ml. El título de IF deberá ser similar al del cultivo conocido de C. sepedonicum.
Para la prueba con berenjenas, las poblaciones celulares deberán ajustarse aproximadamente a 107 células/ml. Las pruebas con berenjenas deberán realizarse utilizando 10 plantas para cada organismo de prueba, utilizando de nuevo un cultivo conocido de C. sepedonicum y controles de agua esterilizada; con cultivos puros deberá obtenerse un marchitamiento típico a partir de los 20 días, pero las plantas que no presenten los síntomas tras este período deberán incubarse durante un período total de 30 días a temperaturas propicias para el desarrollo de las berenjenas, pero sin sobrepasar los 30 °C (véase el Apéndice 5). Si después de 30 días no se presentan los síntomas, no podrá confirmarse que el cultivo es una forma patógena de Corynebacterium sepedonicum.
| Prueba | C. sepedonicum |
|---|---|
| O/F | Inerte o ligeramente oxidante |
| Oxidasa | ‒ |
| Catalasa | + |
| Reducción de nitratos | ‒ |
| Actividad de ureasa | ‒ |
| Producción de H2S | ‒ |
| Producción de indol | ‒ |
| Utilización de citratos | ‒ |
| Hidrólisis del almidón | ‒ o débil |
| Crecimiento a 37 °C | ‒ |
| Crecimiento en NaCl al 7 % | ‒ |
| Hidrólisis de la gelatina | ‒ |
| Hidrólisis de la esculina | + |
| Ácido de: | |
| ‒ glicerol | ‒ |
| ‒ lactosa | ‒ o débil |
| ‒ ramnosa | ‒ |
| ‒ salicina | ‒ |
Apéndice 1
FORMULACIÓN DEL FLUIDO MACERANTE RECOMENDADA POR LELLIOTT Y SELLAR 1976
| Compuesto D C silicona antiespumante MS A (Hopkins & Williams Ltd, Cat n° 9964-25, Chadwell Heath, Essex, England) | 10 ml |
| Copos de LubroI W (ICI. Ltd) | 0,5 g |
| Pirofosfato tetrasódico | 1 g |
| Solución fisiológica con tampón de fosfato 0,05 M pH 7,0 (Apéndice 2) | 1 litro |
Apéndice 2
SOLUCIONES TAMPÓN
Solución fisiológica con tampón de fosfato 0,05 M (PBS) de pH 7,0.
Esta solución puede utilizarse para la maceración de tejidos de tubérculo (2.1).
| Na2HPO4 | 4,26 g |
| KH2PO4 | 2,72 g |
| NaCl | 8,0 g |
| Agua destilada hasta | 1 litro |
Solución fisiológica con tampón de fosfato, 0,01 M (PBS) de pH 7,2.
Esta solución tampón se utiliza para diluir sueros inmunes y lavar los portaobjetos.
| Na2HPO4: 12H20 | 2,7 g |
| NaH2PO4: 2H2O | 0,4 g |
| NaCl | 8,0 g |
| Agua destilada hasta | 1 litro |
Solución de glicerina con tampón de fosfato 0,1 M (PBS) de pH 7,6.
Esta solución tampón se utiliza para aumentar la fluorescencia en la prueba de IF.
| Na2HPO4: 12H2O | 3,2 g |
| NaH2PO4: 2H2O | 0,15 g |
| Glicerol | 50 ml |
| Agua destilada | 100 ml |
Apéndice 3
TINCIÓN DE GRAM (MODIFICACIÓN DE HUCKER’S) (DOETSCH, 1981)
Solución de cristal violeta.
Disuélvanse 2 g de cristal violeta en 20 ml de etanol de 95 %.
Disuélvanse 0,8 g de oxalato amónico en 80 ml de agua destilada.
Mézclense las dos soluciones.
Solución de Lugol.
| Yodo | 1 g |
| Yoduro potásico | 2 g |
| Agua destilada | 300 ml |
Tritúrense conjuntamente los sólidos en un mortero. Añádanse al agua y remuévanse hasta su disolución en un recipiente cerrado.
Solución de contraste de safranina.
Solución base:
| Safranina O | 2,5 g |
| Etanol de 95 % | 100 ml |
Mézclese y consérvese.
Dilúyase al 1:10 para conseguir una solución de trabajo.
Procedimiento de tinción.
1. Prepárense los frotis, séquense con aire y fíjese por calor.
2. Sumérjase el portaobjetos en la solución de cristal violeta durante un minuto.
3. Lávese brevemente con agua corriente.
4. Sumérjase en solución de Lugol durante un minuto.
5. Lávese con agua corriente y séquese.
6. Decolórese con etanol de 95 %, añadido gota a gota hasta que ya no se produzca ningún cambio de color, o sumérjase agitando suavemente durante 30 segundos.
7. Lávese con agua corriente y séquese.
8. Sumérjase en la solución de safranina durante 10 segundos.
9. Lávese con agua corriente y séquese.
Las bacterias grampositivas se colorean de violeta-azul y las gramnegativas de rosa-rojo.
Apéndice 4
DETERMINACIÓN DE LA POBLACIÓN DE CÉLULAS POSITIVAS IF
Superficie (S) de la ventanita del portaobjetos múltiple
(1)
en que D = diámetro de la ventanita.
Superficie (s) del campo del objetivo
(2)
Calcúlese d bien por medición directa bien con las siguientes fórmulas:
(3)
en que i = coeficiente de campo (dependiente del tipo del ocular y varía de 8 a 24).
K = coeficiente del tubo (1 o 1,25).
G = aumento de (100 ×, 40 ×, etc.) objetivo.
(4)
Cuéntese el número de células fluorescentes típicas por campo (c).
Calcúlese el número de células fluorescentes típicas por ventanita (C).
Calcúlese el número de células fluorescentes típicas por ml de sedimento (N)
en que y = volumen de sedimento en ventanita
en que F = factor de dilución sedimento.
Apéndice 5
CULTIVO DE BERENJENAS
Siémbrense semillas de berenjena (Solanum melongena cv. Black Beauty) en «compost» pasteurizado de semillas. Trasplántense los plantones con los cotiledones completamente abiertos (10 a 14 días) en «compost» pasteurizado de tiesto.
Utilícense las berenjenas en su fase foliar 3, cuando tengan de dos a tres hojas como máximo totalmente abiertas.
Las berenjenas deben cultivarse en un invernadero que cumpla las siguientes condiciones ambientales:
duración diurna: 14 horas o día natural si es de mayor duración
temperatura:
‒ día de 21 a 24 °C,
‒ noche 15 °C.
NB: C. sepedonicum no crece con temperaturas >30 °C. Si la temperatura nocturna no baja hasta 15 °C, puede resultar lesionado el cromóforo (necrosis plateada).
La lesión radicular causada por larvas de Scraridae puede superarse aplicando un insecticida apropiado.
Se puede obtener la berenjena cv. Black Beauty en:
1) AB Hammenhögs Frö
270 50 Hammenhög
Suecia
2) HURST Seeds Ltd
Avenue Road
Witham
Essex CM8 2DX
Inglaterra
3) ASGRO Italia Sp.A.
Corso Lodi, 23
Milán
4) KÜPPER
Mitteldeutsche Samen GmbH
Hessenring, 22
D-37269 Eschwege
Apéndice 6
MEDIO DE CRECIMIENTO Y AISLAMIENTO DE LA C. SEPEDONICUM
Agar nutritivo (NA).
Viértase agar nutritivo Difco Bacto en agua destilada en la proporción indicada por el fabricante. Esterilícese en autoclave a 121 °C durante 15 minutos.
Agar de dextrosa nutritivo (NDA).
Agar nutritivo de Difco Bacto con un 1 % de D( + )-gIucosa (monohidrato). Esterilícese en autoclave a 115 °C durante 20 minutos.
Agar de levadura, glucosa, peptona, (YPGA).
| Extracto de levadura Difco Bacto (n.º 0127) | 5 g |
| Difco Bacto Peptona (n.º 0118) | 5 g |
| D( + )-glucosa (monohidrato) | 10 g |
| Agar purificado Difco Bacto (n.º 0560) | 15 g |
| Agua destilada | 1 litro |
Esterilícense volúmenes de medio litro de este medio en autoclave a 115 ºC durante 20 minutos.
Medio de sales minerales, extracto de levadura (YGM).
| Extracto de levadura Difco Bacto | 2,0 g |
| D( + )-glucosa (monohidrato) | 2,5 g |
| K2HPO4 | 0,25 g |
| KH2PO4 | 0,25 g |
| MgSO4 ∙ 7H2O | 0,1 g |
| MnSO4 ∙ H2O | 0,015 g |
| NaCl | 0,05 g |
| FeSO4 ∙ 7H2O | 0,005 g |
| Agar purificado Difco Bacto | 18 g |
| Agua destilada | 1 litro |
Esterilícense volúmenes de medio litro de este medio en autoclave a 115 °C durante 20 minutos.
Apéndice 7
PRUEBAS FISIOLÓGICAS Y NUTRICIONALES PARA LA IDENTIFICACIÓN DE LA C.SEPEDONICUM
Incúbense todos los medios a 21 °C y examínense transcurridos 6 días. Si no se ha producido crecimiento, incúbense hasta llegar a los 20 días.
— Prueba oxidativa y fermentativa (Hugh & Leifson, 1953) - prueba O/F
Medio básico:
| KCl | 0,2 g |
| MgSO4 ∙ 7H2O | 0,2 g |
| NH4H2PO4 | 1,0 g |
| Peptona Difco Bacto | 1,0 g |
| Agar purificado Difco Bacto | 3,0 g |
| D( + )-glucosa (monohidrato) | 10,0 g |
| Azul de bromotimol | 0,03 g |
| Agua destilada | 1 litro |
Mézclese y ajústese a pH 7,0-7,2 con KOH 1N.
Distribúyase en tubos de cultivo Pyrex de 16 mm x 100 mm (12 ml de capacidad), en volúmenes de 5 ml y 10 ml.
Esterilícese en autoclave a 115 °C durante 10 minutos.
Inyéctense por punción los tubos de 5 ml y 10 ml para cada cultivo. Añádanse asépticamente de 1 a 2 ml de parafina líquida estéril al tubo de 10 ml. Incúbese.
| Tubo | Color | Interpretación |
|---|---|---|
|
Abierto Cerrado |
Amarillo Amarillo |
Fermentativa |
|
Abierto Cerrado |
Amarillo Azul-verde |
Oxidativa o inerte |
|
Abierto Cerrado |
Verdoso Azul-verde |
Oxidativa |
‒ Prueba de la oxidasa (Kovacs, 1956).
Reactivo de la oxidasa de Kovacs:
Solución acuosa al 1 % de clorhidrato de tetrametilparafenilnediamina (BDH n.º 30386) en agua destilada.
Este reactivo debe estar recién preparado en volúmenes de 1 ml o puede conservarse en un frasco de vidrio pardo a 5 °C durante 1-4 semanas.
Colóquese una gota del reactivo en un papel de filtro en una placa de Petri limpia. Inmediatamente frótese algo del cultivo para la prueba a partir de agar nutritivo usando una asa de platino.
Reacción positiva: aparece coloración púrpura en el término de 10 segundos. Los cultivos con tiempos de 10-30 segundos son débilmente positivos.
Nota: Tiene importancia fundamental usar una asa de platino y cultivos NA, ya que las trazas de hierro o un elevado contenido de azúcar en el medio de cultivo pueden dar resultados positivos falsos.
‒ Producción de ácido de lactosa, ramnosa, salicina, glicerol.
Prepárese el medio de Hugh & Leifson O/F sin la glucosa. Distribúyase en volúmenes de 5 ml en tubos. Esterilícese en autoclave a 115 °C durante 10 minutos. A la base fundida a 45 °C, añádanse en condiciones de asepsia 0,5 ml de soluciones acuosas al 10 % esterilizadas y filtradas de glicerol, lactosa, ramnosa o salicina. Mézclese cuidadosamente.
Reacción positiva: el cambio de color de verde-azul a amarillo indica la producción de ácido.
‒ Prueba de la catalasa.
Colóquese una gota de peróxido de hidrógeno (30 en volumen) en un portaobjetos limpio y emulsifíquese con una asa de platino llena de cultivo.
Reacción positiva: La producción de burbujas de oxígeno en la gota indica la presencia de catalasa.
‒ Actividad nitrato reductasa y desnitrificación (Bradbury, 1970).
Medio de cultivo:
| KNO3 (libre de nitritos) | 1 g |
| Extracto de levadura Difco Bacto | 1 g |
| K2HPO4 | 5 g |
| Agua destilada | 1 litro |
Distribúyase en volúmenes de 10 ml en frascos de 20 ml. Esterilícese en autoclave a 121 ºC durante 15 minutos.
Reactivo A:
| H2SO4 | 8 g |
| Ácido acético 5N | 1 litro |
Reactivo B:
| Naftilamina | 5 g |
| Ácido acético 5N | 1 litro |
Inocúlese el medio de nitrato por duplicado. Efectúese la prueba al cabo de 10 y 20 días, añadiendo una gota de solución de Lugol, 0,5 ml de reactivo A y 0,5 ml de reactivo B. Si el medio no pasa a color rojizo, añádanse unos 50 mg de polvo de zinc. Obsérvese la reacción de color.
| Reacción positiva | Reacción de color | |
|---|---|---|
| Fase 1 | Fase 2 | |
| Sin reducción de nitratos | incolora | rojo |
| Reducción de nitratos hasta nitritos (nitrato reductasa solamente) | rojo | ‒ |
| Reducción de nitratos más allá de nitritos (desnitrificación ‒ nitrato y nitrito reductasa) | incolora | incolora |
‒ Producción de ureasa (Lelliott, 1966).
Medio básico:
| Agar urea oxoide base (CM53) | 2,4 g |
| Agua destilada | 95 ml |
Esterilícese en autoclave a 115 °C durante 20 minutos. Enfríese la base fundida a 50 °C y en condiciones de asepsia añádanse 5 ml de solución de urea acuosa al 40 % esterilizada y filtrada (Oxoid SR20). Mézclese bien.
Distribúyase en volúmenes de 6 ml en tubos estériles (16 × 100 mm) y déjese sedimentar en forma de pendientes con un buen extremo.
Reacción positiva: el medio amarilio-naranja desarrolla una coloración rosa magenta a rojo cereza si ha habido actividad ureasa.
Utilización de citratos (Christensen) (Skerman, 1967).
| Citrato agar base (Merck 2503) | 23 g |
| Agua destilada | 1 litro |
Mézclese y disuélvase calentando. Distribúyase en volúmenes de 6 ml como para el medio de urea. Esterilícese en autoclave a 121 °C durante 15 minutos y déjese sedimentar en forma de pendientes.
Reacción positiva: la utilización de citratos la indica un cambio de color del medio de naranja a rojo.
– Producción de sulfuro de hidrógeno (Ramamurthi, 1959).
Medio:
| Triptona Difco Bacto (n.º 0123) | 10 g |
| K2HPO4 | 1 g |
| NaCl | 5 g |
| Agua destilada | 1 litro |
Disuélvase y distribúyase en volúmenes de 6 ml en tubos de 16 x 100 mm. Esterilícese en autoclave a 115 °C durante 10 minutos.
Inocúlese y suspéndase, en condiciones de asepsia, un papel de acetato de plomo (Merck 9511) del borde del tubo. Manténgase en dicho lugar con el tapón. Incúbese hasta 20 días.
Reacción positiva: la producción de H2S a partir de la triptona la indica la aparición de una coloración negra-parda del papel de prueba.
‒ Producción de indol (Ramamurthi, 1959).
Medio:
Como para la prueba del H2S.
Retírese el papel de acetato de plomo y añádanse 1-2 ml de dietiléter y agítese suavemente. Déjese que las capas se separen (5 minutos). Añádanse 0,5 ml de reactivo de Kovacs (Merck 9293) haciendo que bajen por el interior del tubo en pendiente.
Reacción positiva: la presencia de indol la indica la aparición de un color rojo en la capa amarilla entre las fracciones de éter y acuosa.
‒ Crecimiento a 37 ºC (Ramamurthi, 1959).
Medio:
| Caldo nutritivo Difco Bacto (n.º 0003) | 8 g |
| Agua destilada | 1 litro |
Mézclese, disuélvase y distribúyase en volúmenes de 6 ml en tubos.
Esterilícese en autoclave a 121 °C durante 15 minutos.
Inocúlese e incúbese a 37 °C.
Reacción positiva: compruébese el crecimiento.
‒ Crecimiento en cloruro sódico al 7 % (Ramamurthi, 1959).
Medio:
| Caldo nutritivo Difco Bacto | 8 g |
| NaCl | 70 g |
| Agua destilada | 1 litro |
Mézclese, disuélvase y distribúyase en volúmenes de 6 ml en tubos.
Esterilícese en autoclave a 121 °C durante 15 minutos.
Reacción positiva: compruébese el crecimiento.
‒ Hidrólisis de la gelatina (Lelliott, Billing & Hayward, 1966).
Medio:
| Gelatina Difco Bacto (n.º 0143) | 120 g |
| Agua destilada | 1 litro |
Mézclese, disuélvase calentando y distribúyase en volúmenes de 6 ml en tubos.
Esterilícese en autoclave a 121 ºC durante 15 minutos.
Reacción positiva: licuefacción de la gelatina incluso si se mantiene a 5 ºC durante 30 minutos.
‒ Hidrólisis del almidón
Medio:
| Agar nutritivo (fundido) Difco Bacto | 1 litro |
| Almidón soluble Difco Bacto º(n.º 0178) | 2 g |
Mézclese, esterilícese en autoclave a 115 °C durante 10 minutos.
Viértase en placas. Háganse siembras puntuales en las placas.
Cuando se haya producido un buen crecimiento (de 10 a 20 días), retírese parte del crecimiento y cúbrase con solución de Lugol.
Reacción positiva: la hidrólisis del almidón la indican zonas claras debajo o alrededor del crecimiento bacteriano; el resto del medio se tiñe de púrpura.
‒ Actividad de esculina hidrolasa (Sneath & Collins, 1974).
Medio:
| Peptona Difco Bacto | 10 g |
| Esculina | 1 g |
| Citrato férrico (Merck 3862) | 0,05 g |
| Citrato sódico | 1 g |
| Agua destilada | 1 litro |
Mézclese hasta disolución y distribúyase en volúmenes de 6 ml en tubos. Esterilícese en autoclave a 115 ºC durante 10 minutos.
El medio es claro, pero presenta una fluorescencia azulada.
Reacción positiva: la hidrólisis de la esculina se manifiesta por la aparición de un color pardo junto con la desaparición de la fluorescencia, lo cual puede comprobarse utilizando una lámpara ultravioleta.
REFERENCIAS BIBLIOGRÁFICAS
Bradbury, J. F., 1970. Isolation and preliminary study of bacteria from plants. Rev. Pl. Path., 49, 213-218.
Dinesen, I. G., 1984. The extraction and diagnosis of Corynebacterium sepedonicum from diseased potato tubers. EPPO Bull. 14 (2), 147-152.
Doetsch, R. N., 1981. «Determinative methods of light microscopy», In: Manual of methods for general bacteriology, American Society for Microbiology, Washington. 21-23.
Hugh, R. F. Leifson, 1953. The taxonomic significance of fermentative versus oxidative metabolism of carbohydrates by various gram-negative bacteria. J. Bact., 66, 24-26.
Janse, J. D. J. Van Vaerenbergh, The interpretation of the EC method for the detection of latent ring rot infections (Corynebacterium sepedonicum) in potato. EPPO Bull., n.º 17, 1987, p. 1-10.
Kovacs, N., 1956. Identification of Pseudomonas pyocyanea by the oxidase reaction. Nature, Lond., 178, 703.
Lelliott, R. A., 1966. The plant pathogenic coryneform bacteria. J. appl. Bact., 29, 114-118.
Lelliott, R. A., E. Billing A. C. Hayward, 1966. A determinative scheme for the fluorescent plant pathogenic pseudomonads. J. appl. Bact., 29, 470-489.
Lelliott, R. A., P. W. Sellar, 1976. The detection of latent ring rot [Corynebacterium sepedonicum (Spiek. et Kotth.) Skapt. et Burkh.] in potato stocks. EPPO Bull., 6 (2), 101-106.
Ramamurthi, C. S., 1959. Comparative studies on some Gram-positive phytopathogenic bacteria and their relationship to the Corynebacteria. Mem. Cornell agric. Exp. Sta. 366, 52 p.
Skerman, V. B. D., 1967. A guide to the identification of the genera of bacteria. Segunda edición, Williams and Wilkins Company, Baltimore.
Sneath, P. H. A. V. G. Collins, 1974. A study in test reproductibility between laboratories: report of Pseudomonas working party. Antonie van Leeuwenhoek, 40, 481-527.
1. En cada caso de brote sospechoso en que se haya realizado una prueba de inmunofluorescencia con resultados positivos de acuerdo con el método establecido en el Anexo I, y se espere recibir confirmación o refutación por aplicación del citado método, se deberá proceder a la retención y adecuada conservación de:
‒ todos los tubérculos o plantas de los que se haya obtenido muestra, a ser posible, y
‒ todos los extractos restantes y los portaobjetos de inmunofluorescencia suplementarios preparados, hasta la aplicación del método arriba mencionado.
2. En caso de confirmación de la presencia del organismo, se procederá a la retención y adecuada conservación:
‒ del material indicado en el apartado 1 y
‒ de una muestra de las berenjenas infectadas inoculadas con extracto de tubérculo o de la planta y
‒ del cultivo aislado del organismo,
durante al menos un mes después de la notificación en virtud del procedimiento establecido en el apartado 2 del artículo 5 de la presente Directiva.
1. Los elementos para la determinación de la probable extensión de la contaminación con arreglo a la letra b) del apartado 1 del artículo 5 incluirán:
‒ los tubérculos o plantas cultivados en un lugar de producción declarado contaminado en virtud de la letra a) del apartado 1 del artículo 5;
‒ el lugar o lugares de producción o las explotaciones relacionadas en alguna medida con la producción de los tubérculos o plantas declarados contaminados en virtud de la letra a) del apartado 1 del artículo 5, incluido el material y las instalaciones de producción compartidos directamente o a través de un contratista común;
‒ los tubérculos o plantas producidos en el lugar o los lugares de producción contemplados en el guion anterior, o presentes en tal(es) lugar(es) de producción durante el período en el que los tubérculos o plantas declarados contaminados según la letra a) del apartado 1 del artículo 5 se encontraban en las explotaciones o en los lugares de producción citados en el primer guion;
‒ los almacenes centrales que manipulen patatas procedentes de los lugares de producción mencionados;
‒ todas las máquinas, vehículos, buques, almacenes o unidades de almacenamiento y cualesquiera otros objetos, incluido el material de embalaje, que pueda haber estado en contacto con tubérculos o plantas declarados contaminados en virtud de la letra a) del apartado 1 del artículo 5, durante los doce meses anteriores o cuando corresponda;
‒ todos los tubérculos o plantas almacenados o que hayan estado en contacto con cualquiera de las estructuras u objetos relacionados en el guion anterior antes de la limpieza y desinfección de los mismos;
‒ como resultado de las pruebas previstas en el artículo 6 los tubérculos o plantas que tengan el mismo origen clonal que los tubérculos o plantas que se hayan declarado contaminados con arreglo a la letra c) del apartado 1 del artículo 5 y para los cuales las investigaciones demuestren que es probable que estén contaminados.
2. Los elementos de la determinación de la posible propagación con arreglo a la letra c) del apartado 1 del artículo 5 incluirán:
‒ la proximidad de otros lugares de producción en los que se cultiven patatas u otras plantas huéspedes;
‒ el carácter común de las existencias de patatas de siembra.
3. Los detalles de la notificación contemplada en el párrafo primero del apartado 2 del artículo 5 de la presente Directiva incluirán:
‒ el pasaporte o número de registro, según el caso, y los certificados estipulados en los artículos 7 y 8 de la Directiva 77/93/CEE de cada lote o partida de patatas que se declare contaminado;
‒ el nombre de la variedad cuando se trate de existencias de patatas de siembra y, a ser posible, en todos los demás casos;
‒ una descripción de los elementos de la declaración de contaminación y de la delimitación de zona;
‒ la disponibilidad de extractos, portaobjetos de inmunofluorescencia preparados, berenjenas infectadas y un cultivo aislado del organismo procedente de la prueba en la que se haya confirmado su presencia.
1. Las medidas bajo control oficial contempladas en el apartado 1 del artículo 7 de la presente Directiva para la eliminación de los tubérculos o plantas declarados contaminados según la letra a) del apartado 1 del artículo 5 serán:
‒ la transformación industrial mediante entrega directa e inmediata a una planta de transformación dotada de instalaciones de eliminación de residuos adecuadas para las que se establezca la ausencia de riesgos detectables de propagación del organismo y de un sistema de desinfección de áreas de almacenamiento y vehículos de transporte, u
‒ otras medidas, siempre que se descarte el posible riesgo de propagación del organismo; estas medidas deberán notificarse a la Comisión y a los demás Estados miembros.
2. El uso o eliminación apropiado de tubérculos o plantas que se consideren probablemente contaminados con arreglo a la letra b) del apartado 1 del artículo 5 contemplado en el apartado 2 del artículo 7, bajo el control de los organismos oficiales responsables de los Estados miembros, incluirá:
‒ su uso como patatas de consumo, embaladas para su distribución y venta directa sin cambio de embalaje y destinadas a dicha distribución y venta directa;
‒ su uso como patatas de consumo para la transformación industrial y destinadas a la entrega directa e inmediata a una planta de transformación dotada de instalaciones de eliminación de residuos y de desinfección adecuadas, o
‒ cualquier otro uso o eliminación, siempre que se establezca la ausencia de riesgos detectables de propagación del organismo.
3. Los métodos apropiados de limpieza y desinfección de todos los objetos contemplados en el apartado 3 del artículo 7 serán aquellos para los que se haya establecido la ausencia de riesgos detectables de propagación del organismo, y se aplicarán bajo el control de los organismos oficiales responsables de los Estados miembros.
4. La serie de medidas contemplada en el apartado 4 del artículo 7 adoptadas por los Estados miembros en la zona delimitada según la letra c) del apartado 1 del artículo 5 de la presente Directiva incluirá las medidas siguientes:
4.1 En los lugares de producción que se declaren contaminados en virtud de la letra a) del apartado 1 del artículo 5:
a) en los campos que se declaren contaminados según la letra a) del apartado 1 del artículo 5 o bien,
i) ‒ al menos durante los tres años de cultivo siguientes al de declaración de la contaminación:
• se adoptarán medidas para eliminar las plantas espontáneas y otras plantas que puedan contener naturalmente el organismo, y
• no se plantarán tubérculos, plantas ni semillas de patata propiamente dichas, ni ninguna otra planta que pueda contener naturalmente el organismo, ni ningún cultivo que presente un riesgo cierto de supervivencia o propagación del organismo, mientras el campo no haya estado exento de plantas espontáneas de patata durante al menos dos años consecutivos;
‒ durante la temporada de cultivo de patata siguiente al período contemplado en el guion anterior se plantarán patatas de siembra certificadas oficialmente sólo para la producción de patatas de consumo, y se llevará a cabo una encuesta oficial con arreglo a lo dispuesto en el apartado 1 del artículo 2 de la presente Directiva;
‒ durante la temporada de cultivo de patata siguiente a la contemplada en el guion anterior y tras un ciclo de rotación adecuado, se plantarán patatas de siembra certificadas oficialmente para la producción de patatas de consumo o de siembra, y se llevará a cabo una encuesta oficial con arreglo a lo dispuesto en el apartado 1 del artículo 2 de la presente Directiva;
ii) ‒ o bien, durante los cuatro años de cultivo siguientes al de declaración de la contaminación:
• se adoptarán medidas para eliminar las plantas espontáneas y otras plantas que puedan contener naturalmente el organismo, y
• se dejará y mantendrá el campo, o bien en barbecho completo, o bien en pasto permanente con siega o pastoreo intensos y frecuentes;
‒ durante la primera temporada de cultivo de patata siguiente al período definido en el guion anterior, se plantarán patatas de siembra certificadas oficialmente para la producción de patatas de consumo o de siembra, y se llevará a cabo una encuesta oficial con arreglo a lo dispuesto en el apartado 1 del artículo 2 de la presente Directiva;
b) en los demás campos,
‒ durante la temporada de cultivo siguiente a la de declaración de la contaminación,
• no se plantarán tubérculos, plantas ni semillas de patata propiamente dichas, ni ninguna otra planta que pueda contener naturalmente el organismo, y se adoptarán medidas para eliminar las plantas espontáneas de patata del modo que se considere necesario; o
• podrán plantarse patatas de siembra certificadas oficialmente sólo para la producción de patatas de consumo, siempre que los organismos oficiales responsables aseguren que se ha eliminado el riesgo de plantas de patata o espontáneas y otras plantas que puedan contener naturalmente el organismo;
‒ al menos durante los dos años de cultivo siguientes al definido en el guion anterior, se plantarán únicamente patatas de siembra certificadas oficialmente para la producción de patatas de consumo o de siembra;
‒ durante cada uno de los años de cultivo contemplados en los guiones anteriores se tomarán medidas para eliminar las plantas espontáneas de patata y las plantas que puedan contener naturalmente el organismo y se llevará a cabo una encuesta oficial con arreglo a lo dispuesto en el apartado 1 del artículo 2 de la presente Directiva;
‒ cuando se planten, para producción destinada al consumo, patatas de siembra certificadas oficialmente, en el año de cultivo siguiente a la declaración de la contaminación, el cultivo se inspeccionará en los momentos oportunos y se someterán a pruebas de detección del organismo todas las plantas espontáneas;
c) inmediatamente después de la declaración de contaminación de acuerdo con la letra a) del apartado 1 del artículo 5 de la presente Directiva y durante todos los años de cultivo siguientes hasta la primera temporada incluida en la que se autorice el cultivo de patata en el campo declarado contaminado, tal como se especifica en la letra a), todas las máquinas e instalaciones de almacenamiento que se encuentren en el lugar de producción e intervengan en la producción de patatas serán limpiadas y desinfectadas como resulte adecuado y con los métodos apropiados, según lo dispuesto en el punto 3;
d) en los sistemas de producción donde sea posible una sustitución completa del medio de cultivo:
‒ no se plantarán tubérculos, plantas ni semillas propiamente dichas hasta tanto la unidad de producción no haya sido sometida a medidas bajo control oficial destinadas a eliminar el organismo y a retirar todas las patatas y otras solanáceas, incluida, como mínimo, la sustitución total del medio de cultivo y la limpieza y desinfección de la unidad de producción y de todos los equipos, y los organismos oficiales responsables no hayan concedido la subsiguiente autorización para la producción de patata; y
‒ la producción de patata procederá de patatas de siembra certificadas oficialmente o de microtubérculos o plántulas derivadas de fuentes probadas.
4.2. Dentro de la zona delimitada, sin perjuicio de lo dispuesto en el punto 4.1, los Estados miembros aplicarán las siguientes medidas:
a) inmediatamente y durante al menos tres temporadas de cultivo después de la declaración de contaminación:
‒ controlarán a través de sus organismos oficiales responsables las explotaciones que cultiven, almacenen o manipulen tubérculos de patata, además de las explotaciones que contraten máquinas para este cultivo,
‒ exigirán la limpieza y desinfección de las máquinas y los almacenes de dichas explotaciones, cuando proceda, con los métodos adecuados, conforme a lo dispuesto en el punto 3,
‒ dispondrán que sólo se plante material de reproducción certificado para todos los cultivos de patatas de la zona,
‒ exigirán que se manipulen por separado las existencias de patatas de siembra y de patatas de consumo recolectadas en la zona,
‒ llevarán a cabo una encuesta oficial según lo dispuesto en el apartado 1 del artículo 2 de la presente Directiva;
b) establecerán un programa, según corresponda, para la sustitución de todas las existencias de patatas de siembra en un período de tiempo conveniente.
Las medidas contempladas en el punto 4.2 y los números de registro de los productores, almacenes colectivos y centros de distribución de la zona delimitada serán notificados cada año a los demás Estados miembros y a la Comisión.
Este documento es de carácter informativo y no tiene valor jurídico.
Ayúdenos a mejorar: puede dirigir sus comentarios y sugerencias a nuestro Servicio de atención al ciudadano
State Agency Official State Gazette
Avda. de Manoteras, 54 - 28050 Madrid