 Este texto consolidado es de carácter informativo y no tiene valor jurídico.
Este texto consolidado es de carácter informativo y no tiene valor jurídico.Incluye la corrección de errores publicada en BOE núm. 146, de 16 de junio de 2010. Ref. BOE-A-2010-9507
[Bloque 2: #pr]
El Instituto Nacional de Toxicología y Ciencias Forenses, de acuerdo con la Ley Orgánica 19/2003, de 23 de diciembre, de modificación de la Ley Orgánica 6/1985, de 1 de julio, del Poder Judicial, y el Real Decreto 862/1998, de 8 de mayo, por el que se aprueba el Reglamento del Instituto de Toxicología, se configura como un órgano técnico cuya misión es auxiliar a la Administración de Justicia.
Dentro de sus funciones está la de emitir los informes y dictámenes que soliciten las autoridades judiciales y el ministerio fiscal, así como practicar los análisis e investigaciones toxicológicas que sean ordenados por las autoridades judiciales, las gubernativas, el ministerio fiscal y los médicos forenses en el curso de las actuaciones judiciales o en las diligencias previas de investigación efectuadas por el ministerio fiscal.
De acuerdo con lo establecido en el artículo 18 del Reglamento citado, para la práctica de peritajes y solicitud de los correspondientes informes, se remitirán al Instituto los elementos que vayan a ser objeto de examen, teniendo en cuenta que para su recogida, preparación o envío habrán de observarse las instrucciones que establezca el Ministerio de Justicia a propuesta del propio Instituto.
La Orden del Ministerio de Justicia de 8 de noviembre de 1996 aprobó las normas para la preparación y remisión de las muestras objeto de análisis por el Instituto de Toxicología.
El tiempo transcurrido desde la publicación de la mencionada Orden, los avances operados en el campo de las ciencias forenses, así como la aparición de nuevas sustancias y productos, exigen nuevas medidas de actuación.
Esta orden tiene por objeto regular, nuevamente, las normas para la recogida, preparación y envío de muestras para su análisis en el Instituto Nacional de Toxicología y Ciencias Forenses, así como la elaboración de nuevos formularios para la remisión de muestras, que presenten con claridad todos los datos necesarios para identificar, de forma inequívoca, los paquetes y las muestras, encauzar correctamente los análisis, asegurar el mantenimiento de la cadena de custodia, así como facilitar el control de las muestras y la devolución o destrucción cuando finalice el procedimiento correspondiente.
Asimismo, los desarrollos tecnológicos del Instituto Nacional de Toxicología y Ciencias Forenses permitirán el envío de toda la documentación relativa al asunto investigado y a las muestras que se remiten, no sólo mediante correo ordinario sino también por vía telemática, mediante formularios tanto impresos como informatizados.
Todo lo expuesto hace necesario la elaboración de la presente orden para adecuar esta normativa a la situación actual.
En su virtud, y a propuesta del Instituto Nacional de Toxicología y Ciencias Forenses, dispongo:
[Bloque 3: #ci]
[Bloque 4: #a1]
Esta orden tiene por objeto regular las normas para la preparación y remisión de las muestras que hayan de ser objeto de análisis por el Instituto Nacional de Toxicología y Ciencias Forenses.
[Bloque 5: #s1]
[Bloque 6: #a2]
1. Las muestras objeto de estudio por el Instituto Nacional de Toxicología y Ciencias Forenses (en adelante INTCF), a efectos del servicio que presta en la investigación pericial forense, deberán ser remitidas a:
a) Departamento de Madrid, las Comunidades Autónomas del Principado de Asturias, Cantabria, Castilla-La Mancha, Castilla y León, Galicia, La Rioja, Comunidad de Madrid, Región de Murcia y País Vasco.
b) Departamento de Barcelona, las Comunidades Autónomas de Aragón, Cataluña, Illes Balears, Foral de Navarra y Comunitat Valenciana.
c) Departamento de Sevilla, las Comunidades Autónomas de Andalucía y Extremadura y a las Ciudades de Ceuta y Melilla.
d) Delegación del Departamento de Sevilla en Santa Cruz de Tenerife, la Comunidad Autónoma de Canarias.
2. A cada uno de estos departamentos o delegación se dirigirán los organismos solicitantes de los diferentes territorios, enviando directamente las muestras y documentación, según más adelante se especifica.
[Bloque 7: #a3]
1. Las autoridades judiciales, gubernativas, ministerio fiscal y los médicos forenses, en el curso de las actuaciones judiciales o en las diligencias previas de investigación, solicitarán los estudios que consideren pertinentes al INTCF, mediante oficio que acompañará a los formularios normalizados, anexos a la presente orden, disponibles en su versión dinámica en la página web del INTCF.
2. En todos los casos se remitirán cumplimentados los formularios normalizados con una información suficiente de todos los datos que puedan tener interés para orientar la investigación.
3. Los dos formularios normalizados se denominan, respectivamente, de remisión de muestras y de remisión de paquetes de muestras.
El formulario de remisión (anexo I) de muestras incluye, en un único documento, la información necesaria para que puedan hacerse los análisis que se solicitan, estructurado en seis ejes:
a) Solicitante: Recoge los datos del organismo solicitante y, en su caso, del órgano de la administración de justicia competente.
b) Datos del asunto: Hace referencia a los detalles más relevantes del caso que se investiga.
c) Estudios solicitados: Categoriza los estudios solicitados dentro de un catálogo de servicios del INTCF.
d) Sujeto/s del estudio: Recoge toda la información relativa a los individuos, sean víctimas, sospechosos, etc., relacionados con el asunto.
e) Muestras: Codifica cada objeto de análisis en cuanto a su origen y al tipo de estudios a realizar sobre los mismos.
f) Cadena de custodia: Registra todos los intervinientes en la toma y cadena de custodia de las muestras.
El formulario de remisión de paquetes de muestras (anexo II) incluye los datos del envío y de la cadena de custodia entre el organismo remitente y el INTCF.
La versión dinámica de los formularios tiene una estructura jerarquizada que facilita la cumplimentación de los campos de datos que se precisen, según el tipo de asunto. Además incorpora ayudas para la introducción de la información y para la toma de muestras.
4. En todos los casos se enviarán cumplimentados los datos de cadena de custodia incluidos en los formularios.
5. Los formularios podrán ser remitidos impresos, en el paquete o por correo postal, y por correo electrónico.
6. La documentación se enviará en sobres con indicación de las referencias del caso al que pertenecen. Los sobres, debidamente protegidos, para evitar su posible contaminación o deterioro, se dispondrán entre el embalaje secundario y el embalaje exterior, definidos en el artículo 4.
7. Si en un mismo embalaje exterior se enviasen muestras de varios individuos o casos diferentes, se hará constar esta circunstancia en el formulario de remisión de paquetes de muestras. Las documentaciones correspondientes deberán enviarse en sobres separados para cada caso, con indicación del caso al que pertenecen en el exterior de cada sobre.
8. En el caso de que fuese necesario utilizar más de un embalaje exterior para el envío de un solo caso, se hará constar en el formulario de remisión de paquetes de muestras.
[Bloque 8: #s2]
[Bloque 9: #a4]
Las muestras que se reciban en el INTCF deberán llevar un triple embalaje de seguridad que constará de:
1. Embalaje primario: En contacto directo con la muestra. Será un recipiente impermeable y estanco de vidrio, metal o plástico dependiendo del tipo de muestra y de la temperatura de transporte.
2. Embalaje secundario: Sirve de protección a uno o más recipientes primarios, será a prueba de derrames. Deberá contener material absorbente suficiente para absorber la totalidad del contenido de los recipientes primarios.
3. Embalaje exterior: Protege al embalaje secundario, caja, cilindro, tambores, etc... Su solidez y dimensiones estarán acorde con las medidas, peso y fragilidad del material a embalar.
[Bloque 10: #a5]
1. Sustancias transportadas a temperatura ambiente o superiores: Los embalajes primarios deberán ser herméticos. Para garantizar su hermeticidad se utilizarán medios eficaces como el sellado al calor, tapón envolvente o cápsula metálica. Si se utilizan recipientes con tapón de rosca deberán reforzarse con cinta adhesiva.
2. Sustancias transportadas refrigeradas o congeladas: El hielo u otros refrigerantes no considerados mercancías peligrosas, deberán colocarse fuera del o de los embalajes secundarios. Es necesario fijar puntales internos para mantener el o los embalajes secundarios en su posición para el supuesto en que se derrita el refrigerante. Si se emplea hielo, el embalaje exterior deberá ser hermético. En el caso de hielo seco, el embalaje exterior deberá permitir la salida del dióxido de carbono (CO2) que se libere.
3. Cuando se utilice transporte aéreo, el embalaje primario deberá soportar el cambio de presión.
[Bloque 11: #s3]
[Bloque 12: #a6]
1. El rotulado es el conjunto de textos explicativos que debe contener todo embalaje con la finalidad de identificar el contenido, origen y destino de la muestra.
2. Los recipientes primarios estarán provistos de una etiqueta rotulada con expresión del contenido, nombre del individuo, en su caso, juzgado, número del procedimiento y fecha u otro sistema de identificación inequívoco.
El embalaje exterior deberá incluir:
a) El formulario de remisión de paquetes debidamente cumplimentado.
b) Datos indicativos del tipo de material que contiene: Biológico, infeccioso, no infeccioso, inflamable, etc., mediante las etiquetas correspondientes.
c) En ningún caso se exhibirán datos que permitan la identificación de personas, casos, antecedentes clínicos o necrópsicos, así como de la investigación ni del contenido del embalaje.
d) Si fuera necesario utilizar más de un embalaje exterior para el envío de un caso determinado se hará constar el número y el orden de los embalajes. En el embalaje que contiene la documentación del caso deberá constar el rótulo «Contiene documentación».
[Bloque 13: #a7]
Las etiquetas deben identificar el tipo de sustancia que contiene el envío y las características especiales de manejo. Deberán ser de material perdurable, legibles y fácilmente visibles en el embalaje exterior.
Salvo lo dispuesto en el artículo 8, respecto a las muestras sometidas a regulación especial, las etiquetas podrán ser:
1. Etiqueta para material biológico:

2. Etiqueta para material diverso (hielo seco):
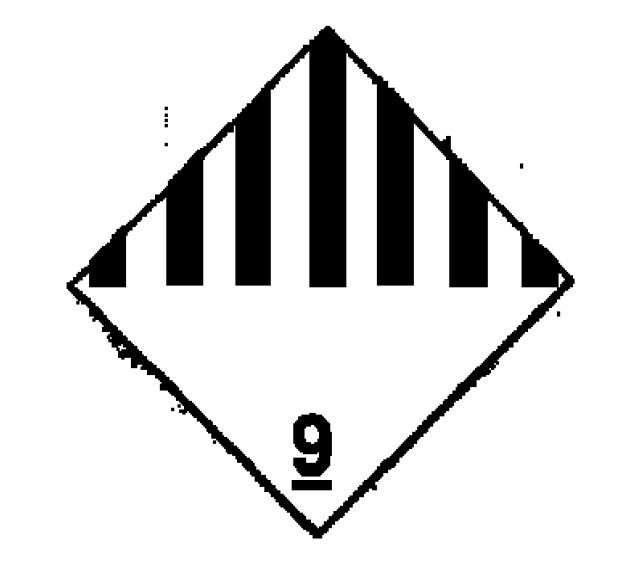
3. Etiqueta indicativa de posición del embalaje:
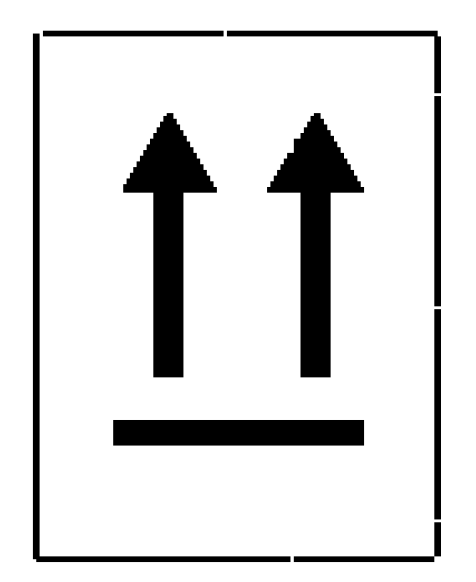
[Bloque 14: #s4]
[Bloque 15: #a8]
Cuando se envíen al INTCF muestras de sustancias que son o se sospeche que puedan ser infecciosas o que por su toxicidad o peligrosidad puedan constituir un riesgo para la salud y/o el medio ambiente, deberá observarse la normativa vigente, específica para cada caso, según el tipo de sustancia o materia, el grado de peligrosidad y el medio de transporte empleado.
[Bloque 16: #a9]
El transporte de muestras sujetas a una regulación especial, dependiendo del medio empleado, se realizará de acuerdo con la siguiente normativa o con la que en su momento sea de aplicación:
1. Transporte terrestre. Se seguirán las normas del Acuerdo Europeo sobre Transporte por Carretera de Mercancías Peligrosas (ADR).
2. Transporte aéreo. Se deberá consultar las Instrucciones Técnicas para el Transporte sin riesgos de Mercancías Peligrosas por Vía Aérea, publicadas por la Organización de Aviación Civil Internacional (OACI).
3. Transporte marítimo. Se aplicará el Código Internacional Marítimo de Mercancías Peligrosas, publicado por la Organización Marítima Internacional (OMI).
4. Transporte por ferrocarril. Será de aplicación el Reglamento relativo al Transporte Internacional de Mercancías Peligrosas por Ferrocarril (RID).
5. Envío postal. La normativa aplicable es la recogida en el Manual del Correo Postal, publicado por la Unión Postal Universal (UPU).
[Bloque 17: #ci-2]
[Bloque 18: #s1-2]
[Bloque 19: #a1-2]
Los estudios toxicológicos se clasifican en:
1. Estudios toxicológicos postmortem encaminados a determinar la ausencia o presencia de sustancias potencialmente tóxicas en fluidos biológicos, tejidos y muestras no biológicas, al objeto de evaluar su papel determinante o su contribución a la causa o mecanismo de la muerte.
2. Estudios toxicológicos en sujetos vivos, al objeto de determinar la ausencia o presencia de sustancias potencialmente tóxicas en muestras biológicas y no biológicas, para contribuir al esclarecimiento del proceso por el que se ha solicitado el estudio.
3. Estudio toxicológico de estupefacientes procedentes de alijos y otras sustancias al objeto de determinar su significación toxicológica forense.
[Bloque 20: #a1-3]
1. Sangre venosa periférica en dos tubos de 5 ml., al menos uno con fluoruro sódico como conservante y oxalato potásico como anticoagulante, completamente llenos sin cámara de aire.
2. Sangre de la cavidad cardíaca, toda la disponible.
3. Líquido pericárdico, todo el disponible.
4. Humor vítreo, todo el que se pueda recoger sin dañar estructuras oculares en su extracción, en tubo de tamaño adecuado para evitar la cámara de aire.
5. Orina, toda la que se pueda recoger en frasco de seguridad de 50 ml.
6. Bilis, toda la que se pueda recoger en frasco adecuado a la cantidad.
7. Contenido gástrico, todo el disponible, que se recogerá en un frasco adecuado a la cantidad. Si no se envía la totalidad, se indicará el volumen inicial del mismo.
8. Vísceras, en frasco de plástico de boca ancha y cierre hermético:
a) Hígado, una cuña de aproximadamente 50 gramos, en fresco, alejada de grandes vasos y vías biliares.
b) Riñón, una cuña de aproximadamente 50 gramos, en fresco.
c) Pulmón, aproximadamente 50 gramos, en fresco.
9. Cabello y pelos. Para el estudio del consumo habitual de drogas de abuso e intoxicaciones crónicas por metales, se enviará un mechón de cabello cortado de la zona occipital y muy próximo al cuero cabelludo, de un grosor mínimo de 7 mm de diámetro. Se depositará sobre un trozo de papel fijado con cinta adhesiva, indicando el extremo próximo a la raíz, zona proximal, y el extremo de la punta, zona distal. Para el estudio del consumo habitual de drogas de abuso, se indicarán las drogas de posible consumo y el tiempo que se quiere investigar.
10. Muestras no biológicas relacionadas con el fallecido: fármacos encontrados en el lugar de los hechos, recipientes o utensilios utilizados, jeringuillas, papelinas llenas o vacías.
[Bloque 21: #a1-4]
1. Sangre venosa periférica en dos tubos de 5 ml., al menos uno con fluoruro sódico como conservante y oxalato potásico como anticoagulante, procurando llenar los tubos al máximo para evitar, en la medida de lo posible, la cámara de aire.
2. Orina, toda la que se pueda recoger en frasco de seguridad de 50 ml.
3. Contenido o lavado gástrico, todo el disponible, que se recogerá en un frasco adecuado a la cantidad.
4. Cabello y pelos. Para el estudio del consumo habitual de drogas de abuso e intoxicaciones crónicas por metales, se enviará un mechón de cabello cortado de la zona occipital y muy próximo al cuero cabelludo, de un grosor mínimo de 7mm de diámetro. Se depositará sobre un trozo de papel fijado con cinta adhesiva, indicando el extremo próximo a la raíz, zona proximal, y el extremo de la punta, zona distal. Para el estudio del consumo habitual de drogas de abuso, se indicarán las drogas de posible consumo y el tiempo que se quiere investigar.
5. Fluido oral. La muestra se tomará con los dispositivos específicos para la misma.
6. Muestras no biológicas relacionadas con el sujeto: fármacos encontrados en el lugar de los hechos, recipientes o utensilios utilizados, jeringuillas, papelinas llenas o vacías.
[Bloque 22: #a1-5]
En caso de alijos superiores a 2,5 kilos se enviarán las muestras resultantes de un muestreo. En los casos de alijos inferiores a 2,5 kilos se enviarán todas las muestras disponibles, preferentemente en su envase original, con la menor manipulación posible.
El muestreo requiere como mínimo [Recomendación del Consejo de la Unión Europea de 30 de marzo de 2004 sobre directrices para la toma de muestras de drogas incautadas (2004/C 86/04)]:
1. Un informe detallado de la incautación: descripción, numeración, ponderación, embalaje, origen, características externas, apariencia, fotos, etc., de las muestras.
2. Una técnica de muestreo basada en los métodos hipergeométrico o bayesiano, con un nivel de confianza del 95% y una proporcionalidad del 50 % (como mínimo la mitad de los productos), o en el método recomendado por las Naciones Unidas.
[Bloque 23: #a1-6]
1. Las muestras destinadas al análisis toxicológico no se conservarán en formol. No se utilizarán los tubos con gel activador de la coagulación ante la posibilidad de que contengan tolueno.
2. Los frascos destinados a contener sangre no deben tener restos de agua para evitar la hemólisis.
3. A las muestras de sangre se añadirá un agente conservante, preferentemente fluoruro sódico, excepto cuando haya de determinarse flúor o sodio. A los restantes tipos de muestras biológicas no se les adicionará ningún conservante.
4. Para el estudio de tóxicos volátiles, monóxido de carbono, gases anestésicos, hidrocarburos volátiles, los envases de las muestras de sangre deberán llenarse al máximo para evitar en lo posible la cámara de aire.
5. Para la determinación de alcohol etílico en sangre en sujetos vivos, la extracción se llevará a cabo con jeringa desechable, no empleándose alcohol o desinfectantes con fracciones volátiles en la desinfección de la piel.
6. El envío se realizará en condiciones de refrigeración.
7. Todas las muestras objeto de análisis, se empaquetaran por separado con la finalidad de evitar una posible contaminación.
8. Para el análisis de metales y metaloides en intoxicaciones crónicas o agudas, se utilizarán recipientes primarios que no contengan sustancias quelantes como el EDTA, remitiéndose las muestras que se indican en la siguiente tabla:
|
VIVO |
CADÁVER |
|||
|---|---|---|---|---|
|
INTOX. AGUDA |
INTOX. CRÓNICA |
INTOX. AGUDA |
INTOX. CRÓNICA |
|
|
ARSÉNICO. |
SANGRE. ORINA. |
PELO. ORINA. |
SANGRE. ORINA. |
PELO. UÑA. ORINA. |
|
MERCURIO. |
SANGRE. ORINA. |
PELO. ORINA. SANGRE. |
SANGRE. ORINA. |
PELO. SANGRE. RIÑÓN. ORINA. |
|
PLOMO. |
SANGRE (nunca suero). ORINA. |
PELO SANGRE. |
SANGRE (nunca suero). ORINA. |
PELO. UÑA. HÍGADO. |
|
CROMO. |
SANGRE. ORINA. |
PELO. ORINA. SANGRE. |
SANGRE. ORINA. |
PELO. UÑA. HÍGADO. RIÑÓN. |
|
CADMIO. |
SANGRE. ORINA. |
PELO. ORINA. SANGRE. |
SANGRE. ORINA. |
PELO. HÍGADO. RIÑÓN. |
|
COBRE Y TALIO. |
SANGRE. ORINA. |
PELO. ORINA. SANGRE. |
SANGRE O SUERO. ORINA. BILIS. |
PELO. UÑA. SANGRE. |
[Bloque 24: #s2-2]
[Bloque 25: #a1-7]
1. Todas las muestras objeto de estudio histopatológico deben ser remitidas en formol tamponado al 4 %. Únicamente se enviarán en fresco aquellas muestras que deban ser objeto de otro tipo de análisis previo, como estudios criminalísticos y de vitalidad en heridas.
2. Para una fijación adecuada, las piezas deben quedar cubiertas totalmente por formol, colocando el fijador antes que la muestra para permitir la fijación de la parte inferior de la misma. La proporción adecuada es: Volumen de la muestra/Volumen de formol = 1/3.
3. Como recipientes se recomienda la utilización de envases de plástico de boca ancha adecuados al tamaño de la muestra, para los encéfalos contenedores de 3 litros y para corazones envases de 2 litros.
4. Las muestras en formol se mantendrán a temperatura ambiente.
[Bloque 26: #a1-8]
1. Encéfalo. Se enviará preferentemente completo e íntegro con tronco y cerebelo hacia arriba, en contenedor de seguridad de 3 litros y con abundante formol. Si el estudio macroscópico lo realiza el médico forense, deberá seccionarlo en cortes coronales, tras 15 días de fijación en formol. A continuación, pueden enviarse al servicio de histopatología todas las secciones coronales.
2. Corazón. Se enviará completo incluyendo la totalidad de las aurículas. Puede enviarse íntegro o seccionado en dos, mediante corte transversal por la mitad del cono ventricular por debajo de los músculos papilares de la válvula mitral para preservar el aparato valvular. El cono ventricular también puede enviarse en varias secciones transversales obtenidas mediante cortes paralelos al surco aurículo-ventricular posterior. La base cardíaca, opcionalmente, puede enviarse abierta siguiendo la dirección de la corriente sanguínea. La aurícula derecha debe abrirse desde la desembocadura de la vena cava inferior a la orejuela derecha, para preservar el nodo sinusal del sistema de conducción.
Los corazones operados, prótesis valvulares, o bypass, deben enviarse completos y sin corte alguno. En caso de cirugía coronaria, tratar de preservar los injertos aortocoronarios y buscar posibles injertos pediculados de arteria mamaria interna.
Los corazones con cardiopatías congénitas, si es posible, deben enviarse completos, sin cortes y perfundidos.
3. Pulmón. Se enviará muestra de los 5 lóbulos pulmonares y de los hilios, preferentemente en dos envases, indicando su pertenencia al pulmón derecho o izquierdo. Se cubrirán con papel poroso o paño y se llenará el recipiente completamente de formol.
4. Hígado, Bazo, Páncreas. Se deben enviar secciones de unos 2 centímetros de grosor: una sección de cada lóbulo hepático, una de bazo y otras de cabeza y cola de páncreas.
5. Glándulas suprarrenales. Se remitirán completas.
6. Riñones. Se enviará la mitad de cada riñón en sección longitudinal media.
7. Vísceras huecas. Se enviarán abiertas y lavado su contenido. El estómago debe abrirse por curvatura mayor. El contenido gástrico se remitirá en envase aparte, si interesan otros análisis.
8. Útero y anejos. El útero se enviará abierto, separando la cara anterior de la posterior, para lo cual se seccionarán los bordes laterales desde el cuello con una tijera y posteriormente el fondo con cuchillo. Los anejos se dejan unidos a la cara posterior del útero.
9. Líquidos para citología pleural, pericárdica y peritoneal. Se enviarán en fresco lo antes posible, refrigerados, o bien, diluidos en alcohol del 50-60% en proporción 1:1. También pueden enviarse extensiones ya fijadas durante 4-5 minutos en una mezcla de alcohol-éter, a partes iguales, o bien en metanol puro. Una vez secos, fijados e identificados, se introducirán en un contenedor de plástico para portaobjetos.
10. Médula ósea hematopoyética. Se remitirá un segmento costal de 3 a 4 cm y/o un fragmento de esternón de tamaño similar al anterior, fijados también en formol.
11. Músculo psoas ilíaco. Se remitirá un fragmento longitudinal representativo, fijado en formol.
[Bloque 27: #a1-9]
1. Muerte súbita del adulto, joven y adolescente. Se enviará encéfalo en caso de sospecha de enfermedad neurológica, corazón, pulmón, hígado, bazo, páncreas, glándula suprarrenal, riñón y otros, según hallazgos de autopsia y antecedentes clínicos. En caso de disección de aorta se enviará ésta unida al corazón.
2. Muerte súbita del lactante. Se realizará la investigación según protocolo internacional adoptado por el INTCF. Se deben enviar todos los órganos, bien el bloque visceral tóraco-abdominal completo, o bien separados en dos recipientes el bloque torácico y el bloque abdominal. En ambas modalidades conviene remitir el tubo digestivo resecado y abierto para mejor conservación de la mucosa. El encéfalo, íntegro, según las normas generales. También se enviará músculo psoas, diafragma con el bloque abdominal, médula espinal, cuerpos vertebrales para estudio de médula ósea, y unión costo-condral para estudio de placa de crecimiento.
3. Embarazo y aborto. Se remitirán, el útero abierto, separadas cara anterior de posterior, excepto en caso de perforación, la placenta con cordón umbilical, el embrión completo e íntegro para determinación de la edad gestacional. Si se trata de un feto, se remitirán las vísceras en un recipiente y el resto en otro.
4. Anafilaxia. Se indicarán las circunstancias de la muerte, el tiempo transcurrido entre la exposición al alergeno y la muerte, la sintomatología y antecedentes si se conocen. Se remitirán las vías respiratorias superiores, inferiores y pulmón, y muestras para descartar muerte súbita.
5. Iatrogenia. Se remitirá historia clínica, tratamientos, tipo de intervención realizada, fecha de ingreso y de muerte, entre otros datos. Las muestras se tomarán según el caso de que se trate. En general, el muestreo será de todos los órganos, como si se tratara de una muerte súbita, y en caso de intervenciones quirúrgicas, conviene enviar un esquema o fotos con las lesiones encontradas y en caso de investigarse una posible perforación de víscera hueca o un punto de sangrado, se indicará la zona problema con hilo de sutura.
6. Intoxicaciones. El muestreo se hará según el órgano diana y los órganos asociados a la cinética del tóxico. Como norma general se recomienda, además, un extenso muestreo de órganos, como para los casos de muerte súbita, con el fin de identificar otras patologías que en último término puedan ser las responsables de la muerte, y no el tóxico inicialmente sospechado.
7. Muertes relacionadas con drogas de abuso. Muestreo completo como para casos de muerte súbita. En el caso de tratarse de un trasportador de drogas en su aparato digestivo se remitirá además el intestino.
8. Muerte violenta del recién nacido. Se deberá hacer un muestreo completo de todos los órganos, considerando opcional la práctica de la docimasia respiratoria o test de flotación por parte del médico forense. Se enviará la placenta completa unida al resto del cordón umbilical y su zona de inserción en el abdomen acompañado de un ojal de piel.
9. Muerte por sumersión. Se enviará pulmón, muestras de los 5 lóbulos y de los hilios, y un muestreo general como para los casos de muerte súbita.
10. Muerte por ahorcadura y estrangulación. Se realizará la descripción del tipo de ahorcadura y de los hallazgos de autopsia, se remitirá un muestreo bilateral de las estructuras del cuello previamente disecadas: perímetro cervical completo, ambos músculos esternocleidomastoideos, ambos paquetes vásculo-nerviosos, arterias carótidas, venas yugulares y nervios y el complejo hioides-laringe.
11. Traumatismos. Se remitirá una descripción precisa de las lesiones y esquemas de las mismas. Para descartar patología previa al traumatismo se hará un muestreo completo como en casos de muerte súbita.
En casos de traumatismo cráneo encefálico es aconsejable la remisión del encéfalo de acuerdo con lo establecido en el artículo 16.1.
12. Heridas. Para diagnostico de vitalidad se tomarán muestras de piel problema y piel control.
13. Muertes en incendio. Se remitirán las vías aéreas superiores y pulmón para estudio de negro de humo y, en su caso, la piel de quemaduras para estudio de vitalidad. Se hará asimismo un muestreo completo para descartar muerte súbita.
14. Muertes por electricidad. Se incluirá un informe de las circunstancias de la muerte. Se remitirá piel para el estudio de quemaduras y marca eléctrica. Se hará asimismo un muestreo completo para descartar muerte súbita.
[Bloque 28: #s3-2]
[Bloque 29: #s1-3]
[Bloque 30: #a1-10]
1. En muestras líquidas se utilizarán como recipientes primarios, botes o botellas de plástico, de boca ancha, con tapón a rosca, obturador y perforaciones, aptos para ser precintados, de una capacidad de 2.000 ml.
Si se requieren análisis microbiológicos, los envases deberán ser estériles con posibilidad de ser precintados y de una capacidad mínima de 500 ml.
2. En muestras sólidas se utilizarán envases de plástico de boca ancha o bolsas de plástico flexible, resistentes y de dimensiones adecuadas, con auto cierre y precintables. La cantidad mínima de muestra requerida para realizar los análisis, es de 500 g.
3. Para la investigación de compuestos orgánicos, como los derivados del petróleo, los envases deberán ser de vidrio.
4. Para la investigación de metales los envases deberán ser de plástico.
5. Los envases estarán todos etiquetados y precintados. En la etiqueta, se harán constar al menos los siguientes datos:
a) Identificación de la muestra.
b) Localización del punto de muestreo.
c) Fecha de la toma.
d) Hora de la toma.
e) Diligencias policiales, judiciales, etc.
f) Nombre de quien toma la muestra.
g) Firma de quien toma la muestra.
6. Las muestras para estudios relacionados con delitos medioambientales deberán remitirse urgentemente y refrigeradas, a ser posible antes de que transcurran 24 horas desde su toma.
[Bloque 31: #a1-11]
1. Clases de contaminantes:
a) Vertidos líquidos y/o pastosos.
b) Residuos sólidos y líquidos.
c) Gases y material particulado.
2. Clases de medios receptores:
a) Aguas continentales:
1.º Aguas superficiales.
2.º Aguas subterráneas.
b) Aguas de mar.
c) Suelos.
d) Atmósfera.
[Bloque 32: #a2-2]
1. Cuando se investigue el potencial tóxico de un determinado vertido sobre alguno de los medios receptores anteriormente expuestos, se tomarán muestras en el punto exacto de vertido antes de mezclarse con el medio receptor.
2. Cuando se investigue el potencial tóxico de un residuo, las muestras se tomarán de diferentes lugares del mismo para poder determinar sus características físicas y químicas globales. Las muestras se tomarán de las zonas que se observen menos alteradas por el efecto de los agentes meteorológicos.
3. Cuando se investigue una emisión a la atmósfera de gases o material particulado, se tomarán las muestras con captadores adecuados y se enviarán los cartuchos, filtros o viales de captación, sellados. Si es posible se tomarán muestras tanto del foco de emisión como de las zonas presuntamente afectadas.
[Bloque 33: #a2-3]
1. Cuando se investigue el potencial tóxico de un determinado vertido en una corriente de agua superficial, se tomarán muestras de aguas arriba del punto de vertido, muestra de referencia no afectada por el vertido, y aguas abajo, a una distancia orientativa de 50 m, donde la mezcla con el vertido sea homogénea. La toma de muestras se deberá efectuar cerca de la corriente principal, a una profundidad media evitando la proximidad de la orilla.
2. En lagos y embalses se deben evitar áreas de turbulencia para minimizar la perdida de componentes volátiles en la muestra. Se muestreará desde la superficie descendiendo progresivamente en profundidad y se tendrá la precaución de no remover el fondo, a fin de no recoger partículas sedimentadas.
3. Para la investigación de acuíferos se tomarán muestras de agua en pozos, dejando bombear el agua al menos dos minutos.
4. Para la investigación en aguas de abastecimiento, se deberá dejar correr el agua por las tuberías al menos dos minutos, antes de realizar la toma de muestras.
5. Para la investigación de un terreno contaminado por un vertido o residuo, se ha de enviar una muestra del suelo afectado por la contaminación y otra, de características similares, del entorno que no esté afectado por la contaminación del vertido.
[Bloque 34: #a2-4]
Se tomarán las muestras en envases de plástico de 2.000 ml de capacidad. Dada la posibilidad de fermentación de estas muestras, se deberán utilizar envases provistos de doble tapa, la primera con cierre a presión y la segunda con cierre de rosca, u otro tipo de envases adecuados para evitar la sobrepresión.
[Bloque 35: #a2-5]
1. En caso de vertidos o fugas desde barcos petroleros o cualquier otro tipo de barco o depósito fijo o flotante, se tomarán muestras del producto contaminante en el origen del vertido, en la estela de los hidrocarburos flotantes, en las playas o riberas afectadas y en los fondos. El número de muestras a tomar se determinará de acuerdo con el laboratorio.
2. En caso de vertidos o fugas en suelos, deberá enviarse muestra del producto original vertido, muestras del suelo contaminado y de aguas de pozos o manantiales cercanos para el estudio de la afectación del acuífero correspondiente. El número de muestras a tomar se determinará de acuerdo con el laboratorio.
3. En todos los casos, las muestras se tomarán antes de la aplicación de emulgentes y dispersantes. Los recipientes se llenarán en su totalidad para evitar la pérdida de fracciones volátiles.
[Bloque 36: #s2-3]
[Bloque 37: #a2-6]
Se enviará cualquier material que pueda tener relación con el origen del incendio, como botellas, recipientes con su contenido y vacíos. Se empaquetarán individualizados en cajas de cartón como contenedor primario y en bolsas de plástico cerradas como contenedor secundario. Los posibles acelerantes se enviarán en recipientes de vidrio o metal.
[Bloque 38: #s3-3]
[Bloque 39: #a2-7]
1. En el caso de mortandad de peces se remitirán muestras de agua.
2. En el caso de muertes de mamíferos y aves, se enviará el contenido estomacal del animal.
3. En el caso de existir en el entorno recipientes sospechosos de haber contenido el tóxico, se enviarán íntegros, con las etiquetas comerciales o inscripciones, con el fin de orientar la investigación.
[Bloque 40: #s4-2]
[Bloque 41: #a2-8]
Los estudios biológicos se clasifican en:
1. Estudios de identificación genética.
2. Estudio de diatomeas e hidremias en casos de muerte por sumersión.
3. Estudios bioquímicos en casos de muertes súbitas e intoxicación.
4. Estudios microbiológicos en casos de muertes de etiología no aclarada.
5. Estudio de identificación de setas y plantas superiores en casos de intoxicación.
6. Estudios entomológicos.
[Bloque 42: #s1-4]
[Bloque 43: #a2-9]
Los estudios de identificación genética que se realizan son:
1. Investigación biológica de la paternidad y/o maternidad.
2. Identificación de restos cadavéricos.
3. Identificación de indicios biológicos de interés criminal procedentes del lugar de los hechos.
4. Identificación de indicios biológicos procedentes del cuerpo de la víctima y/o sospechoso.
5. Identificación de indicios biológicos en casos de agresión sexual.
6. Identificación genética de muestras clínicas.
[Bloque 44: #a2-10]
1. Contaminación por material biológico humano. Se debe al depósito de material biológico humano, en el lugar de los hechos y/o en el cuerpo de la víctima, con posterioridad a la producción del delito. Esta contaminación puede ser causada por personas ajenas a la investigación, como curiosos o familiares, o por personas que colaboran en la investigación, de forma accidental o por desconocimiento. Puede tener lugar durante el proceso de recogida de indicios si no se mantienen unas precauciones mínimas y/o por defectos en el empaquetado de las muestras.
2. Transferencia de indicios biológicos. Se debe al traslado, normalmente accidental, de los indicios de una localización a otra, lo que puede dar lugar a su contaminación o a su pérdida. Los vestigios biológicos que sufren con más facilidad este cambio de localización son los pelos.
3. Contaminación microbiológica. Este tipo de contaminación tiene lugar por el desarrollo de microorganismos y suele estar favorecida por la humedad y las altas temperaturas. Normalmente se produce o incrementa por defectos en el empaquetado y conservación de las muestras hasta su envío al laboratorio.
4. Contaminación química. Se debe a la presencia de productos químicos que van a dificultar algunos de los procesos del análisis genético, fundamentalmente la amplificación y extracción de ADN. Se produce fundamentalmente cuando las muestras se envían inmersas en productos conservantes como el formol o cuando se realizan estudios previos con sustancias químicas, como el revelado de huellas dactilares, que pueden comprometer el análisis de ADN.
5. Degradación del ADN. El uso de luz ultravioleta para la búsqueda de indicios puede dañar la estructura del ADN.
6. Interferencia con los análisis posteriores, eliminación o enmascaramiento de vestigios por el uso de reactivos para revelar manchas latentes.
[Bloque 45: #a2-11]
La toma de muestras se realizará de la siguiente forma:
1. Aislar y proteger lo más rápidamente posible el lugar de los hechos y recoger los indicios biológicos.
2. Usar guantes limpios y cambiarlos con frecuencia, especialmente cuando se manipulan indicios biológicos susceptibles de tener distinto origen.
3. Evitar hablar, toser o estornudar sobre las muestras. Usar mascarilla.
4. Usar bata, calzas u otro tipo de ropa protectora.
5. Utilizar instrumental desechable de un solo uso siempre que sea posible o limpiarlo bien antes de recoger cada indicio biológico.
6. No añadir conservantes a las muestras.
7. Dejar las muestras secar a temperatura ambiente, en un lugar protegido, antes de empaquetarlas para su envío al laboratorio.
8. Empaquetar cada muestra por separado.
9. Empaquetar las muestras en bolsas de papel o cajas de cartón evitando utilizar plástico. Los hisopos deben ser introducidos en cajas específicas para los mismos.
10. Es recomendable el uso de equipos que trabajen con luz en el rango visible del espectro.
11. Se recomienda el uso de reactivos con compatibilidad conocida para análisis genéticos.
12. Enviar inmediatamente las muestras al laboratorio.
[Bloque 46: #a3-2]
Con independencia del estudio que se vaya a realizar deberán enviarse las muestras indubitadas de las personas relacionadas con el caso.
1. Muestras de personas vivas:
a) Epitelio bucal. Para la toma de muestras se frotará la cara interna de los carrillos y encías con dos hisopos estériles secos. Los hisopos serán introducidos en cajas de cartón específicas para hisopos. En caso de empaquetar estas cajas se deberán dejar secar los hisopos al menos una hora, para evitar la degradación del ADN.
b) Sangre. Se recogerán 5 ml de sangre en un tubo con EDTA como anticoagulante. Enviar refrigerado.
c) Pelos arrancados con raíz. Se usarán para comparación morfológica. Se tomarán tres pelos de cada región anatómica que representen la variabilidad morfológica de los pelos del sujeto. El número total de pelos no será inferior a diez. Los pelos serán introducidos en diferentes sobres de papel convenientemente etiquetados.
d) En personas transfundidas recientemente y/o con trasplantes de médula ósea, es obligatoria, como muestra de referencia, una toma bucal, además de la sangre.
2. Muestras de cadáveres:
a) Cadáveres en buen estado de conservación. Se remitirán:
1.º Sangre: se recogerán 10 ml en dos tubos con EDTA como anticoagulante. Enviar refrigerada.
2.º Músculo esquelético: se obtendrán dos fragmentos de músculo, de unos 10 g, de las zonas mejor conservadas. Se deben envasar en frascos de boca ancha con cierre hermético. Se enviarán refrigerados.
3.º Piezas dentales: si existen dudas sobre la conservación del cadáver, conviene extraer cuatro piezas dentales, si es posible molares, como reserva, a fin de evitar la posible exhumación del cadáver.
b) Cadáveres carbonizados. Enviar sangre semisólida de la cavidad cardiaca, músculo de zonas preservadas, piezas dentales y hueso largo, como el fémur.
c) Cadáveres en avanzado estado de putrefacción o esqueletizados. Si su estado lo permite, enviar sangre y músculo de zonas preservadas. En todos los casos se deben enviar:
1.º Piezas dentales: Al menos 4 piezas que no estén dañadas, si es posible molares, que se enviaran en una bolsa de papel.
2.º Huesos: Siempre que sea posible un hueso largo, preferiblemente el fémur, que debe limpiarse de restos de putrílago y enviarse en una caja de cartón, si no hay restos de tejidos blandos, o en un recipiente de plástico.
d) Cadáveres embalsamados o momificados. Se deberán valorar las muestras más adecuadas en función de la antigüedad, técnica de embalsamamiento, etc., de acuerdo con el laboratorio.
e) Otras muestras de referencia de restos de fallecidos:
1.º Análisis de restos biológicos del fallecido existentes en centros hospitalarios. Es posible analizar muestras de sangre, biopsias incluidas en parafina, preparaciones histológicas, etc.
No es recomendable el análisis de tejidos conservados en formol durante mucho tiempo, a no ser que sea la única muestra disponible, ya que este compuesto modifica el ADN, dificultando, cuando no imposibilitando la obtención de resultados.
2.º Análisis de restos biológicos del fallecido que aún permanezcan en el ámbito familiar. Es posible analizar muestras que contengan restos biológicos del fallecido como sobres, sellos con restos de saliva, maquinillas de afeitar, peines, cepillos, etc. Estas muestras en muchos casos deben ser autentificadas mediante análisis genético de familiares.
3.º Restos fetales. Se analizarán los restos fetales, placentarios y el cordón umbilical. Se enviarán refrigerados.
[Bloque 47: #a3-3]
1. Cuando el presunto padre, el hijo y/o la madre están vivos se enviará una muestra de referencia de sangre o muestra bucal de cada uno de ellos, según se describe en el artículo 29.1.
2. Cuando el presunto padre biológico ha fallecido hay tres posibles estrategias:
a) Análisis de restos óseos, según se describe en el artículo 29.2 letras a), b), c) y d) de muestras de cadáveres.
b) Análisis de restos biológicos del fallecido existentes en centros hospitalarios o en el ámbito familiar, según se describe en el artículo 29.2.e).
c) Análisis de muestras biológicas procedentes de familiares del fallecido. Se enviaran muestras de referencia de sangre o muestra bucal de cada uno de los familiares, según se describe en el artículo 29.1.
Los familiares recomendados para el análisis biológico de paternidad, de mayor a menor eficacia son:
1.º Ambos abuelos paternos.
2.º Hijos biológicos adicionales del presunto padre fallecido, al menos dos, y la/s madre/s de éstos.
3.º Hermanos biológicos del presunto padre fallecido, al menos dos.
4.º Otros familiares. La eficacia es limitada. Consultar con el laboratorio las distintas posibilidades.
3. Investigación de paternidad a partir de restos fetales. Se enviarán los restos fetales y placentarios, cordón umbilical o el líquido amniótico y muestras de referencia de la madre y el supuesto padre.
[Bloque 48: #a3-4]
1. Muestras procedentes del cadáver o restos cadavéricos: se recogerá la muestra según establece el artículo 28. Si se sospechase que los restos cadavéricos corresponden a varios individuos, resulta necesario enviar las muestras por separado en la forma ya indicada.
2. Los familiares más adecuados para proceder a la identificación, por orden de prioridad, son los siguientes:
a) Ascendientes y descendientes directos para estudios de paternidad con marcadores STRs autosómicos.
1.º Padre y madre biológicos del fallecido.
2.º Hijos del fallecido y el otro progenitor de éstos.
b) Hermanos del fallecido. Si la víctima es un varón es recomendable la obtención de muestras de hermanos varones para investigar la línea paterna mediante marcadores de cromosoma Y, además de la línea materna mediante ADN mitocondrial. Con estos familiares se reduce el poder de discriminación.
c) Otros familiares. Si no es posible obtener muestras de los familiares anteriormente descritos, es recomendable la obtención de muestras de familiares que mantengan la línea paterna y/o materna. Consultar con el laboratorio las distintas posibilidades.
[Bloque 49: #a3-5]
1. Manchas secas en muestras de fácil transporte. En general, este tipo de muestras serán recogidas e introducidas cada una por separado en bolsas de papel o cajas de cartón. Las muestras más frecuentes son:
a) Colillas. Deben recogerse con pinzas limpias e introducirse por separado en bolsas de papel o cajas de cartón pequeñas.
b) Chicles. Deben recogerse con pinzas limpias e introducirse por separado en envases de plástico duro.
c) Sobres y sellos. Sin despegarse, se recogen con unas pinzas limpias y se introducen en bolsas de papel o plástico.
d) Armas blancas. Se deben recoger con precaución para no afectar al estudio de huellas dactilares y colocarlas, por separado, en cajas de cartón especialmente preparadas para este tipo de muestras, de tal manera que queden bien sujetas. Si no se cuenta con este tipo de cajas, se debe proteger la hoja e introducir por separado en bolsas de papel.
e) Llaves, monedas, joyas y similares. Se deben recoger con unas pinzas limpias e introducir por separado en bolsas de papel.
f) Piedras, ramas, hojas y similares. Se deben recoger de forma adecuada para evitar contaminaciones e introducir por separado en bolsas de papel.
g) Billetes, papeles, cartones pequeños y similares. Se procederá en forma análoga al apartado anterior.
2. Manchas secas en muestras no transportables de superficie no absorbente. En estos casos las muestras, cristales, metales y similares, pueden recogerse frotando con un hisopo estéril ligeramente mojado en agua destilada o suero salino, para su introducción inmediata en cajas para hisopos; o bien raspando la mancha con un bisturí sobre un papel que debe ser cuidadosamente doblado e introducido en una bolsa de papel.
3. Manchas secas en muestras no transportables de superficie absorbente. Para estas muestras, cortinas, alfombras y similares, lo más adecuado es recortar las manchas con un bisturí o unas tijeras y enviarlas por separado en bolsas de papel.
4. Ropas con indicios húmedos. Hay que dejarlas secar en un lugar protegido, sobre una superficie limpia. Una vez secas, empaquetarlas por separado en bolsas de papel. Si se recogen en bolsas de plástico, para su traslado al lugar de secado, se deben mantener en plástico el tiempo imprescindible para su traslado y desempaquetar inmediatamente.
5. Preservativos con semen. Se atan bien para que no se derrame el contenido y se introducen en frascos de plástico de boca ancha. Enviar refrigerados.
6. Orina u otros fluidos. Deben recogerse con una pipeta de plástico desechable e introducirse en tubos o frascos de plástico de boca ancha. Enviar refrigerados.
7. Pelos dubitados. Los pelos dubitados deben ser recogidos con unas pinzas limpias colocando cada pelo o cada grupo de pelos en un papel pequeño que debe ser doblado con cuidado e introducido en una bolsa de papel pequeña.
[Bloque 50: #a3-6]
1. Manchas de saliva, sangre, semen u otros fluidos biológicos en el cuerpo de la víctima. Recoger las manchas con hisopos estériles ligeramente mojados con agua destilada o suero salino. Limpiar todo el área presionando suavemente y si es posible con un solo hisopo. Introducir en cajas de cartón específicas para hisopos.
2. Saliva en marcas de mordeduras. Recoger la mancha con hisopos estériles ligeramente mojados con agua destilada. Limpiar de forma circular la marca dejada por los dientes y toda el área interior que delimitan. Introducir en cajas de cartón específicas para hisopos.
3. Uñas. Examinar las manos y uñas, recogiendo con unas pinzas los pelos o fibras existentes. Cortar el borde distal de las uñas para analizar en el laboratorio la posible presencia de restos de sangre y piel. Recoger por separado cada uña sobre un papel que debe ser cuidadosamente doblado e introducido en una bolsa de papel pequeña. En cadáveres no extraer la uña completa sino solo el borde distal.
4. Pelos dubitados. Los pelos dubitados deben ser recogidos con unas pinzas limpias colocando cada pelo o cada grupo de pelos en un papel pequeño que debe ser doblado con cuidado e introducido en una bolsa de papel pequeña.
[Bloque 51: #a3-7]
1. Tomas bucales para búsqueda de semen. Se recogerán los posibles restos de semen con dos hisopos estériles que se pasaran con cuidado y sin frotar mucho, por debajo de la lengua, alrededor de las encías, de los dientes y por el paladar. Se introducirán en cajas de cartón específicas para hisopos.
Esta es la primera toma que debe realizarse, ya que en la boca los restos de semen desaparecen con cierta celeridad.
2. Superficie corporal. Hay que buscar manchas de saliva, sangre o semen, mordeduras o similares que deben recogerse con hisopos estériles según se ha descrito en el artículo 34, puntos 1 y 2.
3. Peinado de vello púbico y recogida de pelos dubitados. Mediante peinado suave para no arrancar pelos de la víctima, sobre un papel blanco, enviándose tanto el peine como el papel sobre el que se ha realizado el peinado.
4. Tomas vaginales, cervicales y de genitales externos. Se deben obtener con dos hisopos estériles secos limpiando la cavidad vaginal, dos para el cuello uterino y uno para la región vulvar.
La toma de los hisopos deberá realizarse de la zona exterior a la interior, primero la vulva, después la cavidad vaginal y por último el cuello uterino para no arrastrar hacia adentro los posibles restos o que estos queden adheridos al palo del hisopo y no al absorbente del mismo. Esta toma deberá realizarse antes de hacer el lavado vaginal. Los hisopos se introducirán en cajas de cartón específicas para ellos.
5. Lavado vaginal. Se lleva a cabo después de la toma con hisopos, para lo cual se utilizarán unos 10 ml de suero fisiológico estéril que se recogerá en un tubo o frasco de plástico. Enviar refrigerado.
6. Tomas anales y del margen anal. Deben ser obtenidas limpiando con dos hisopos estériles secos el conducto ano rectal y el margen anal, respectivamente. No enviar heces.
7. Las ropas vestidas por la víctima en el momento de la agresión deberán envolverse cada una por separado en papel, e introducirse en bolsas de papel independientes.
Es aconsejable el uso del kit de agresiones sexuales del INTCF.
[Bloque 52: #a3-8]
1. Bloques de parafina y portaobjetos con cortes histológicos. Se enviaran por separado en bolsas de papel pequeñas o en estuches para portaobjetos.
2. Líquido amniótico. Se recogerá una muestra de unos 10 ml que se introducirá en un tubo o frasco de plástico. Enviar refrigerado.
[Bloque 53: #s2-4]
[Bloque 54: #a3-9]
Las muestras deberán recogerse en frascos separados, de boca ancha y cierre hermético, para evitar la contaminación cruzada. Se evitará el contacto de las vísceras con las muestras del medio líquido en el que se produjeron los hechos. Se enviarán refrigeradas y sin líquido fijador.
[Bloque 55: #a3-10]
1. Muestras procedentes del cadáver.
a) Sangre de ambos ventrículos. Se deberá recoger la mayor cantidad de sangre de ambos ventrículos por separado e introducirla en sendos tubos con EDTA como anticoagulante. Es conveniente realizar la extracción por punción intracardiaca evitando abrir el corazón.
b) Pulmón. Porciones distales de los diferentes lóbulos, principalmente el inferior derecho de 100 a 200 gramos.
c) Esternón o fémur para estudio de la médula ósea.
d) Sistema nervioso central. Duramadre, cerebelo completo y plexos coroideos.
e) Bazo e hígado. Unos 100 g de cada órgano.
2. Muestras procedentes del medio líquido donde se han producido los hechos. Se recogerán unos 100 ml. En cauces profundos es recomendable tomar muestras a diferentes alturas: profunda, media y superficie.
[Bloque 56: #s3-4]
[Bloque 57: #a3-11]
1. En casos de muerte súbita, el tiempo máximo que puede haber transcurrido desde el momento de la muerte hasta la toma de muestras es de una hora. Para la determinación de glucosa, urea, creatinina y cloruros se enviarán las muestras que a continuación se relacionan:
a) Humor vítreo, 0,5 ml que se introducirán en un tubo de ensayo estéril sin adición de ningún tipo de sustancia.
b) Sangre, 1 ml con heparina, como anticoagulante. Para la determinación de glucosa la sangre será introducida en tubos con fluoruro sódico-oxalato potásico.
2. En casos de intoxicación por plaguicidas organofosforados o carbamatos, para determinación de acetilcolinesterasas y/o pseudocolinesterasas, el tiempo máximo que puede haber transcurrido desde el momento de la muerte hasta la toma de muestras es igualmente de una hora. Deberá enviarse 1 ml de sangre en un tubo con EDTA o heparina como anticoagulante, refrigerado.
[Bloque 58: #s4-3]
[Bloque 59: #a4-2]
Los supuestos más frecuentes de muerte de etiología desconocida en los que se debe realizar análisis microbiológico son:
1. Muerte inesperada de posible origen infeccioso.
2. Muerte súbita cardiaca.
3. Muerte súbita del lactante y del niño.
[Bloque 60: #a4-3]
La toma de muestra de biopsias, de tejidos/órganos, orina y aspirados se hará en tubos o frascos estériles de boca ancha y tapón de rosca, adecuados al tamaño de la muestra. Se prestará especial atención al cierre de los envases para evitar derrames.
Las muestras para el análisis microbiológico, pueden verse afectadas por numerosos procesos: contaminación microbiológica con flora cutánea o exógena, migración bacteriana postmortem, degradación de las muestras, alteración de la viabilidad de los patógenos que pueden contener, etc. por ello se deberán tomar una serie de precauciones encaminadas a proteger las muestras:
1. El cadáver debe ser conservado a 4 ºC lo antes posible y hasta la realización de la autopsia.
2. El personal implicado en la autopsia debe realizar un lavado quirúrgico previo.
3. Antes de comenzar la autopsia, se lavará el cadáver con un antiséptico eficaz. Si esto no es posible, al menos se lavarán las zonas donde se vaya a practicar la toma de muestra para microbiología o donde se vaya a realizar la apertura de cavidades.
4. La autopsia se realizará en un período que no supere las 24 horas desde la muerte y preferentemente en las primeras 15 horas.
5. Las muestras de sangre y otros fluidos corporales, exudado nasofaríngeo, orina y heces, se tomarán al comienzo de la autopsia.
6. No se debe emplear el oxalato como anticoagulante, ni el fluoruro como conservante, por ser tóxicos para muchos microorganismos.
7. Los exudados se deberán recoger mediante hisopos de poliéster o cualquier otro material sintético, nunca de algodón o alginato de calcio. Se evitaran los hisopos con vástagos de madera. Los hisopos deberán introducirse en un medio de transporte que será diferente según la patología que se sospeche; Amies o Stuart para bacteriología o como medio de transporte viral. Se tomarán al menos dos hisopos en cada caso.
8. Si se desconoce si la etiología es viral o bacteriana, habrá que tomar la misma muestra con los dos sistemas de transporte por separado.
9. Si se sospecha una infección por anaerobios, se inocularán en un vial de anaerobios que se enviará al laboratorio, inmediatamente, sin refrigeración.
10. La apertura de cavidades y disección de órganos, se realizará empleando las técnicas de esterilidad y asepsia quirúrgicas usuales. Se evitará romper vasos sanguíneos u otros órganos, especialmente el intestino.
11. Las muestras se obtendrán esterilizando la superficie del órgano con una espátula ardiente y cortando bloques de tejidos desde la zona central del área cauterizada o aspirando fluidos a través de ésta.
12. Se aconseja realizar tomas de dos o más órganos empleando un kit de instrumentos estériles para cada órgano o tejido.
13. Los envases para análisis microbiológicos no se compartirán con otros análisis.
14. Se deberá reseñar la hora de la toma de muestra y el tiempo transcurrido entre la muerte y su envío.
[Bloque 61: #a4-4]
1. Sangre y suero sin conservantes. La sangre, preferiblemente periférica, y el suero, son muestras obligatorias en cualquier muerte súbita infecciosa, sea cual sea el cuadro clínico. Se podrá tomar también de las venas subclavia, femoral o axilar.
Se procederá a la desinfección de una porción de piel de 16-20 cm2, primero con una gasa impregnada con alcohol y a continuación se friccionará con otra gasa o algodón impregnado de una solución antiséptica eficaz. Una vez seca la piel se procederá a la aspiración aséptica de sangre de la vena con una jeringa. Se cambiará de aguja para la inoculación de la sangre en los envases adecuados.
Se recomienda recoger tres tubos de 3 a 5 ml. Uno de sangre con citrato trisódico o, en su defecto, polianetol sulfonato sódico (SPS), como anticoagulantes, para cultivo bacteriológico. Otro de sangre con EDTA, como anticoagulante, para técnicas moleculares (PCR) y un tercero con el suero obtenido mediante centrifugación de un tubo de sangre con activador de coagulo, para análisis antigénicos y serológicos.
Si se sospechara una infección sistémica, es recomendable inocular parte de la muestra de sangre, entre 5 a 10 ml, en frascos para hemocultivo. Esta muestra se contamina muy fácilmente y por eso nunca deberá sustituir a las muestras de sangre anteriormente citadas.
No se utilizarán tubos con oxalato o fluoruro.
2. Líquido cefalorraquídeo (LCR). La toma se podrá realizar en el conducto raquídeo, por punción lumbar percutánea, en cisterna magna o en ventrículos laterales.
La zona de piel donde se va a realizar la punción lumbar se desinfectará con un antiséptico eficaz antes de proceder a la extracción de la mayor cantidad posible de líquido.
3. Tejidos y órganos en fresco. Es recomendable hacer el estudio de bazo, pulmón, miocardio, cerebro, riñón, hígado y glándulas suprarrenales.
Se tomarán cuñas de 1 cm3, en las condiciones de asepsia ya indicadas, de cada uno de los órganos indicados que se introducirán en recipientes estériles separadamente.
Es aconsejable tomar una muestra de cada lóbulo del pulmón, especialmente en los casos de muerte súbita infantil, en las que el aspecto macroscópico del pulmón puede inducir a error con respecto a la existencia de infección.
Se reseñará la localización exacta de donde se obtuvo la muestra, el lóbulo del pulmón de que se trate o la región sospechosa del órgano.
4. Orina. Es la muestra de elección para el diagnóstico rápido de legionella y para el diagnóstico, mediante técnicas antigénicas, de la neumonía por Streptococcus pneumoniae.
Se recogerá por punción de la vejiga y se introducirá en recipientes estériles.
5. Exudados faríngeos. Se recogerán, al menos dos hisopos, que se rotaran varias veces por la región amigdalar, especialmente de la zona con exudado o inflamación. Uno de estos hisopos deberá introducirse en un medio de transporte específico para virus.
Se evitará la zona labial, bucal, lengua y úvula, contaminadas con flora saprofita.
6. Aspirado nasofaríngeo. Se recomienda para el estudio de virus respiratorios y ante la sospecha de infección por Bordetella pertussis.
Se obtendrá mediante aspiración de cada una de las fosas nasales, con ayuda de una sonda que se introducirá por la fosa nasal hasta llegar a la vía aérea superior o con una torunda nasofaríngea, que incorpora un medio de transporte como el de Stuart, que se rotará varias veces por la región nasofaríngea. Ante la sospecha de infección viral se tomará una segunda torunda con medio de transporte para virus.
7. Otros fluidos corporales: Líquidos pleural y abdominal. Exudados purulentos. En casos de infección localizada son útiles: el líquido pleural para el diagnóstico de neumonía, sobre todo si hay empiema y el líquido libre en cavidad abdominal ante la sospecha de peritonitis.
Se recogerán mediante aspiración con aguja y jeringa estériles, extrayendo con cuidado todo el aire que se haya introducido, para mantener las condiciones de anaerobiosis, y se dispondrán en un tubo o frasco estéril.
Ante la sospecha de infección por microorganismos anaerobios se deberán introducir en envase con medio de transporte específico.
Los exudados purulentos, se recogerán con un hisopo con medio de transporte Amies o Stuart.
8. Aspirado bronquial. Se realizará ante la sospecha de infección respiratoria. Se obtendrá mediante la introducción de una jeringa estéril en el bronquio lobar inferior, inmediatamente después de la separación de los bronquios principales. Se extraerá el aire que se haya introducido en el recipiente, en el que se remite al laboratorio, para intentar mantener las condiciones de anaerobiosis.
9. Heces. La muestra de heces es necesaria en caso de antecedentes de gastroenteritis, sospecha de una toxiinfección alimentaria, miocarditis aguda y muerte súbita del lactante.
Las heces se recogerán con espátula o cucharilla y se dispondrán en envase estéril. Si no es posible su obtención se usará un hisopo rectal, al menos por duplicado, en medio de transporte adecuado a la patología sospechada.
10. Abscesos y heridas.
a) Abscesos: en los cerrados la toma se hace aspirando el pus con jeringa y aguja, preferiblemente a través de una zona de piel sana. Si no se obtuviera una muestra se podrá inyectar suero salino estéril subcutáneo y volver a aspirar. Una vez realizada la aspiración, se debe expulsar el aire inoculando la muestra en tubo estéril, preferentemente con medio de transporte para anaerobios. En los abscesos abiertos la muestra se tomará con hisopo.
b) Heridas: previa desinfección de la zona más externa de la piel, mediante una torunda, se muestreará el tejido celular subcutáneo de los bordes de la herida o de la base de la lesión. En el caso de heridas muy secas, se recomienda impregnar la torunda con suero salino estéril antes de realizar la toma.
11. Oído medio. Se recomienda ante la sospecha de infección meníngea o diseminada con antecedentes de otitis bacteriana.
La toma de muestra se realizará con torunda provista de medio de transporte, Amies/Stuart, tras la limpieza del conducto auditivo externo con un antiséptico.
[Bloque 62: #a4-5]
1. Sospecha de infección bacteriana fulminante: se recomienda recoger dos tubos de sangre, uno con citrato sódico y otro con EDTA, suero, LCR, tejidos/órganos en fresco y orina. Los principales órganos son: bazo, pulmón, miocardio, cerebro, riñón, hígado y glándulas suprarrenales. Estas últimas son especialmente importantes ante la sospecha de infección meningocócica o ante el diagnóstico de un síndrome de Waterhouse-Friderichsen.
Ante el supuesto de una peritonitis bacteriana, además de la sangre y el bazo se remitirá líquido peritoneal, en envase específico de anaerobios.
Si se observan adenopatías, también se recomienda el análisis de ganglios.
2. Sospecha de intoxicación alimentaria o gastroenteritis: son imprescindibles tanto la sangre, que permite confirmar la septicemia, como las heces.
3. Muerte súbita del lactante y del niño: antes de la autopsia se recomienda la toma de aspirado nasofaríngeo, exudado faríngeo, heces, sangre, suero, LCR, fluidos corporales e hisopo de lesiones.
Durante la autopsia se recomienda tomas de tejidos, principalmente bazo, pulmón, miocardio, cerebro, hígado, hisopos bronquiales y exudados purulentos.
4. Muerte súbita cardiaca: sospecha de enfermedad miocárdica de origen infeccioso.
a) Muestras en fresco: sangre con EDTA, suero y corazón en fresco, una porción de 3 a 5 g de punta de miocardio en envase estéril y preferentemente en medio de transporte viral.
Hisopos faríngeo y nasofaríngeo recogidos con medio de transporte preferentemente viral.
Pulmón, líquido pleural y aspirado bronquial si hubiera existido sintomatología respiratoria.
En caso de diarrea los días previos a la muerte, heces en recipiente estéril o hisopo rectal con medio de transporte preferentemente viral.
b) Muestras fijadas: es prioritario que este análisis se efectúe con la mayor rapidez desde que se establece el diagnóstico histológico.
Se tomarán secciones de parafina de miocardio, procedentes de dos zonas del corazón seleccionadas según los hallazgos histopatológicos: una zona con infiltrado inflamatorio y otra de una zona control con celularidad normal. De cada una de ellas se tomarán 5-6 cortes, cada uno de ellos de 5 micras, que se dispondrán en tubo Eppendorf estéril y se mantendrán refrigeradas hasta su análisis.
5. Otros supuestos clínicos. En los restantes supuestos en que se considere adecuado realizar un estudio microbiológico, las muestras se tomarán de la forma indicada, de acuerdo a los antecedentes clínicos y a los hallazgos macroscópicos de autopsia, consultando cualquier duda con el servicio de biología del Departamento de Madrid del INTCF.
[Bloque 63: #a4-6]
Todas las muestras para análisis microbiológico se remitirán al servicio de biología del Departamento de Madrid del INTCF.
El traslado de las muestras debe realizarse de forma inmediata. Las muestras deben conservarse a una temperatura entre 2-8 ºC. Si el envío se va a retrasar más de 24-48 horas, la muestra podrá ser congelada a –70 °C, manteniendo la cadena de frío durante el transporte.
[Bloque 64: #s5]
[Bloque 65: #a4-7]
Se enviará el contenido del estómago refrigerado, en un frasco de cierre hermético sin conservantes.
Igualmente, se remitirá un ejemplar completo de la seta sospechosa de intoxicación o, de no ser posible, restos de la misma. Estas muestras se enviarán por separado, en frascos sin conservantes.
[Bloque 66: #s6]
[Bloque 67: #a4-8]
1. Las muestras para estudios entomológicos deberán tomarse en el lugar donde fue encontrado el cuerpo, tanto del cadáver, como bajo el mismo y en sus proximidades. En su caso, y siempre considerando las condiciones ambientales y el tiempo que transcurra, podrán obtenerse también durante la práctica de la autopsia.
Se deberá obtener un registro de la temperatura ambiental de los días previos en el lugar donde fue hallado el cadáver, a través de la Agencia Estatal de Meteorología o el organismo correspondiente en las comunidades autónomas, así como del agua o del suelo si se ha encontrado el cadáver en alguno de estos medios.
2. Para completar el estudio entomológico se deberá aportar la siguiente información:
a) Si se trata de una muerte violenta con heridas abiertas.
b) La fase de descomposición en la que se encuentra el cadáver.
c) La fecha y hora de recogida de las muestras entomológicas.
d) El lugar del hallazgo y la situación del cadáver:
Si fue encontrado al aire libre, se describirá: el medio circundante, la orientación, la temperatura, la humedad, etc. Si es posible, se remitirán fotografías.
Si fue localizado en un espacio cerrado, se informará: de la situación del cadáver dentro de este espacio, de las condiciones ambientales del mismo, en especial la temperatura, luz, ventilación y condiciones higiénicas y de la presencia de medios físicos que actúen modificando estas condiciones tal como calefacción/aire acondicionado.
Asimismo, se deberá indicar si el cuerpo permaneció en condiciones especiales, como sumergido, enterrado, quemado u otras.
3. Los recipientes deberán ser etiquetados con indicación de la procedencia anatómica de los especímenes.
[Bloque 68: #a4-9]
1. Larvas y puparios. Las muestras se dividirán en dos grupos:
En el primero las larvas se matan previamente introduciéndolas en un recipiente con líquido conservante, alcohol al 70 % con unas gotas de glicerina, en el que se remitirán al laboratorio.
En el segundo se introducirán y remitirán larvas vivas acompañadas de un sustrato alimenticio como por ejemplo hígado de pollo.
2. Insectos adultos o imagos. Se remitirán en un bote con virutas de madera y un algodón impregnado en acetato de etilo.
[Bloque 69: #s5-2]
[Bloque 70: #a4-10]
La investigación criminalística tiene como objetivo establecer o descartar mediante procedimientos científicos el cotejo positivo o el descarte del mismo, entre muestras dubitadas, aquellas de las que no tenemos seguridad en cuanto a su procedencia e indubitadas o de referencia.
Los estudios criminalísticos se pueden clasificar en:
1. Estudio de indicios.
2. Estudio de residuos de disparo.
3. Estudio de signos de violencia en las ropas, cuerdas y otros objetos.
4. Estudio de lesiones.
5. Estudios antropológicos y odontológico forenses.
6. Estudios de documentoscopia y grafística.
[Bloque 71: #a4-11]
Se considera indicio a todo material biológico o no biológico, objeto o fragmento que pueda encontrarse en el lugar de los hechos, sobre la víctima o sobre un sospechoso y de cuyo estudio pueda llegar a establecerse una evidencia en la reconstrucción del suceso.
Para la correcta toma de muestras, el entorno debe ser convenientemente aislado y protegido con el fin de evitar las posibles contaminaciones y/o pérdidas de los indicios; para ello el operador deberá contar con el equipamiento y el instrumental adecuados para la búsqueda, recogida y embalaje de las muestras para su traslado al laboratorio.
Se tomarán tanto muestras dubitadas como indubitadas, recogiendo las dubitadas en primer lugar.
Se utilizarán diferentes soportes para recoger y empaquetar las muestras dubitadas y las indubitadas, que se remitirán siempre por separado, en contenedores apropiados al tamaño y tipo de muestra, correctamente etiquetados y precintados.
En caso de que los indicios se encuentren en prendas húmedas, se deberán dejar secar a temperatura ambiente y en lugar protegido, sin exposición al sol ni a secadores. Se remitirán en bolsas de papel, evitando el plástico.
[Bloque 72: #a5-2]
1. Pelos y cabellos:
a) Pelos y cabellos dubitados. Los pelos y cabellos dubitados presentes en la cabeza y el pubis se obtendrán mediante un peinado suave, para evitar que sean arrancados. Los que se encuentren en las manos, uñas y superficie corporal se recogerán con pinzas estériles, que se lavarán entre recogida de muestra y muestra con alcohol al 70 %. En ambos casos, la toma se realizará sobre un papel blanco, enviándose al laboratorio tanto el peine como el papel sobre el que se ha realizado el muestreo, plegado e introducido en un sobre de papel convenientemente etiquetado.
Aquellos que se localicen sobre superficies textiles, se recogerán mediante un soporte ligeramente adhesivo distinto para cada prenda o zona a muestrear. Este soporte se pegará sobre una hoja de acetato, nunca sobre sí mismo.
b) Pelos y cabellos indubitados. Los pelos indubitados deberán ser siempre arrancados. Se recogerán de la misma zona anatómica de la que procedan los pelos dubitados.
Se tomarán de diferentes zonas en número suficiente, nunca inferior a 10 que, en todo caso, deberán representar la variabilidad morfológica del sujeto.
2. Fibras:
a) Fibras dubitadas. Se remitirán las prendas o soportes sobre el que se encuentren las fibras, envasándose separadamente.
Si no es posible remitir el soporte, se recogerán las fibras dubitadas con pinzas o papel adhesivo, que se depositará sobre una superficie de acetato.
La recogida de fibras en el pelo, se realizará con un peine con algodón en la base.
Para el estudio de fibras en uñas, recortar éstas lo máximo posible y remitir separadamente las uñas, indicando su procedencia.
En el muestreo se tratará de evitar la contaminación cruzada con las fibras de las prendas del operador.
b) Fibras indubitadas. Se remitirán todas las ropas y tejidos que sean útiles para el cotejo.
Si la muestra indubitada se encuentra sobre un soporte que no se pueda transportar, se remitirá un fragmento del mismo que sea representativo del color y del tipo de fibras de que se componga.
3. Escamas y manchas de pintura:
a) Muestra dubitada. Se buscarán fragmentos de pintura en el lugar de los hechos y en los efectos personales y ropas de la víctima, que se recogerán siempre con pinzas.
Los fragmentos de pintura adheridos a las heridas se remitirán en fresco y refrigerados, de acuerdo con lo dispuesto en el artículo 52.
Los restos de pintura pueden transferirse de un soporte a otro, no obstante, cuando la transferencia de pintura sea mínima, se remitirá con el soporte de origen.
b) Muestra indubitada. Las muestras se recogerán de la zonas próximas al área en que hayan tenido lugar los hechos.
Para el muestreo se utilizará un cuchillo limpio o un escalpelo. En el caso de vehículos se profundizará hasta la chapa metálica, y en el caso de edificios o tapias, hasta el substrato de la pared.
Cuando la muestra indubitada proceda de un vehículo, se enviarán también los datos sobre el color, marca, modelo, matrícula y zona del vehículo donde se ha recogido la muestra.
Para evitar mezclar las diferentes capas de pintura o contaminar la muestra, no se rasparán las superficies ni se utilizará cinta adhesiva.
4. Vidrios: Las muestras de vidrio se remitirán separadamente, en contenedores estancos apropiados a su tamaño.
Siempre que sea posible se remitirán muestras indubitadas. Se especificará con claridad cuáles son las muestras dubitadas y cuáles las indubitadas, proporcionando información sobre el origen de las mismas.
5. Explosivos: Se tomarán las muestras en la zona cercana al foco de la explosión, recogiendo con pinzas las partículas sospechosas. Se recogerán además aquellos elementos cercanos al foco de la explosión que tengan propiedades absorbentes, fragmentos de piel, telas, tapicerías, alfombras, etc. y se remitirán en contenedores de vidrio.
En caso de no existir fragmentos sospechosos, se frotará la zona a investigar con algodón impregnado en acetona, remitiendo otro algodón impregnado en acetona como control negativo. Los algodones se remitirán en botes de vidrio, nunca de plástico.
Si se encontraran restos del embalaje del explosivo se remitirán envueltos en papel o incluidos en contenedores de vidrio.
6. Investigación de incendios: Acelerantes.
Se recogerán en el punto de inicio del incendio los materiales absorbentes que haya, como madera, tapicerías, telas, etc. y se remitirán las muestras en envases de vidrio o metálicos, nunca de plástico.
7. Identificación del contenido gástrico: se remitirá la totalidad del contenido gástrico en un bote cerrado y refrigerado.
Se reseñarán los datos relativos a: ingesta de alimentos, tiempo de digestión, estado de la dentadura, consumo de alcohol, fármacos u otras sustancias, así como la edad, posibles patologías, o cualquier otro dato relacionado.
8. Huellas dactilares: se manipulará el objeto sospechoso siempre con guantes para evitar contaminaciones y se remitirá bien protegido y correctamente etiquetado, especificando en la etiqueta exterior que se solicita estudio de huellas.
[Bloque 73: #a5-3]
La toma de muestras se realizará de forma inmediata, tanto sobre el cadáver como sobre el sospechoso si su detención es cercana a los hechos, a fin de evitar la pérdida de residuos.
1. Recogida de residuos en manos. La toma de muestras se realizará preferiblemente en el lugar de los hechos. Si no fuera posible, se protegerán las manos con bolsas de papel hasta la realización de la toma de muestras.
Se utilizará el «Dispositivo de Recogida de Residuos de Disparo» diseñado a tal fin por el INTCF u otros similares empleados por los cuerpos y fuerzas de seguridad del Estado.
En el caso de que no se disponga de estos dispositivos, se recogerán, de los sujetos vivos, las prendas exteriores que vistan en el momento de los hechos, en envoltorios distintos para cada prenda. Del cadáver se recortará la piel de la cara dorsal y de la región interdigital entre pulgar e índice, por ambas caras, tanto de la mano derecha como de la izquierda, que se enviarán en recipientes independientes, en refrigeración y sin conservantes.
2. Recogida de residuos de disparo en ropas. Se evitará la manipulación de las prendas. Cada prenda se remitirá por separado envuelta en papel.
[Bloque 74: #a5-4]
Se remitirán todas las prendas relacionadas con los hechos, secas y envueltas en papel. En caso de que estén mojadas o húmedas, se dejarán secar a temperatura ambiente en un lugar protegido antes de su envío. Se indicarán las zonas a estudiar, diferenciándolas de aquellas que han sido alteradas en la autopsia o en el reconocimiento de la víctima.
Si se precisa el estudio de objetos vulnerantes sospechosos se remitirán conforme a lo indicado en el artículo 52.1.
Si se precisará conocer el mecanismo de corte practicado sobre una cuerda se especificará cuál de los extremos es el dubitado.
Se aportará toda la información disponible sobre los hechos.
[Bloque 75: #a5-5]
1. Heridas punzantes, incisas o contusas producidas por arma blanca o por objetos contundentes: Se recortará un colgajo cutáneo amplio, alrededor de cada una de las heridas. Los colgajos se remitirán en fresco y refrigerados, utilizando siempre un bote de plástico de boca ancha para cada colgajo.
Se reseñará la región anatómica a la que pertenece cada colgajo siendo conveniente orientar la pieza con hilos de sutura o marcas, o remitir un esquema de las lesiones. Si es posible se remitirán fotografías.
Se deberán indicar todos los datos relativos al número y localización de las heridas, así como la profundidad de las mismas en el cadáver.
Si existen objetos vulnerantes sospechosos, se remitirán en contenedores normalizados para muestras peligrosas, o en envases rígidos con las zonas punzantes o cortantes bien protegidas para evitar accidentes. Si son varios los objetos, se remitirán por separado y correctamente identificados.
2. Surcos de ahorcadura: Se seguirán las mismas instrucciones que para las heridas por arma blanca. Es fundamental orientar la pieza.
Si existe lazo se remitirá a fin de establecer la compatibilidad entre lazo y surco.
3. Cordón umbilical: Se remitirá el cordón en fresco y refrigerado. Se reseñará claramente cuál es el extremo fetal o placentario.
4. Heridas por arma de fuego: Las muestras con los orificios de disparo no serán manipuladas, para salvaguardar sus características y no introducir modificaciones en el patrón inicial del disparo. No se lavarán ni rasurarán las zonas heridas antes de su remisión.
Se recortará un colgajo cutáneo, amplio, alrededor de cada orificio. Los colgajos se remitirán en fresco y refrigerados, utilizando siempre un bote de plástico de boca ancha para cada colgajo.
Se reseñará la región anatómica a la que pertenece cada colgajo y se enviará piel indemne como control negativo.
Se remitirán siempre las ropas afectadas, secas y dobladas, de modo que se evite, en la medida de lo posible, el contacto entre los diversos orificios. Para ello, si la separación entre unos y otros lo permite, podrán protegerse colocando sobre ellos un papel que se fijará mediante cinta adhesiva. Cada prenda se remitirá en un envoltorio independiente de papel, convenientemente etiquetado.
Se enviará toda la información disponible, especialmente en aquellos casos en los que la víctima recibe más de un impacto, así como todos los datos disponibles relativos al tipo de arma, munición, asistencia médica del fallecido, etc.
[Bloque 76: #a5-6]
1. Restos óseos y dentarios. Es fundamental aportar la mayor cantidad de datos posibles referidos al lugar de los hechos tales como: Informe fotográfico del levantamiento, mapa del lugar, croquis o dibujo a escala del mismo; descripción pormenorizada del tipo de enterramiento y del lugar: casa de campo, habitación, descampado, cueva, pantano, monte bajo o similares; tipo de suelo: color, aspecto cohesión, textura; condiciones ambientales: temperatura y humedad del lugar donde se hallaron los restos; la orientación de los mismos; exposición al sol; fauna general, tanto animales predadores como insectos.
Se remitirán los objetos hallados con los restos tales como vestidos, ornamentos, prótesis dentales y similares.
Se tomarán muestras de la tierra situada inmediatamente debajo de la caja torácica y de las cavidades abdominal y pélvica.
Se remitirá toda la información disponible de datos antropológicos y odontológicos antemortem tanto morfológicos como ocupacionales y patológicos.
a) Restos esqueletizados. Se remitirán todos los restos sin manipular, ni limpiar, envueltos en papel dentro de cajas de cartón, preferentemente de pH neutro, provistas con algún sistema de amortiguación de golpes.
b) Restos no esqueletizados. Se remitirá el cráneo completo, el fémur y la tibia, región anterior de la parrilla costal atlas, axis, alguna otra vértebra y el coxal. Todos desprovistos de partes blandas que habrán de ser retiradas.
Se remitirán, lo antes posible, en bolsas de plástico o embalados en recipientes herméticos e impermeables, preferentemente refrigerados.
2. Material radiográfico. Las radiografías, en proyección antero-posterior y, si fuera necesario, lateral y ortopantografías se remitirán en sobres acolchados.
[Bloque 77: #a5-7]
En los documentos privados u oficiales podemos distinguir dos tipos:
1. Documentos manuscritos.
2. Documentos impresos.
[Bloque 78: #a5-8]
1. Documentos dubitados: son siempre originales, nunca fotocopias. Se hará constar la parte del documento objeto del estudio.
2. Documentos indubitados: se consideran documentos indubitados los contemplados en el artículo 350 de la Ley 1/2000, de 7 de enero, de Enjuiciamiento Civil. Deberán proceder tanto de la víctima como de los sospechosos.Se indicará el nombre y edad de la persona a la que corresponden, así como la fecha en la que se han realizado y cualquier otro dato que se considere de interés.
A efectos periciales los documentos indubitados provienen de dos fuentes distintas: escritos espontáneos y escritos dictados.
a) Escritos espontáneos. Pueden corresponder a diarios, cartas, libros de registro, etc., preferiblemente largos. Deberán enviarse el mayor número posible de textos coetáneos con dicho documento y ser lo más semejantes al documento dubitado, tanto en el soporte utilizado, como en el instrumento empleado.
b) Escritos dictados. Se dictará el texto de autos, ocultando el original y otro texto en el que entren las palabras, frases o cifras del escrito dubitado, pero en distinta composición. Se realizarán con los mismos materiales que los del texto dubitado tales como papel de igual calidad y tamaño, mismo tipo de útil de escribir, etc.
Se indicará el tipo de letra a utilizar: Mayúsculas, minúsculas, tipográfica o caligráfica. No se harán indicaciones sobre la ortografía o sobre los signos de puntuación.
La velocidad en cada dictado irá incrementándose. Al principio debe ser lenta dando tiempo al sujeto para escribir todo el texto, repitiéndolo si hiciera falta; al final el sujeto no debe tener tiempo para escribir todo el texto, que además no será repetido.
El texto dictado será realizado al menos 10 veces.
Tras cada dictado, debe retirarse el papel y esperar al menos cinco minutos antes de comenzar uno nuevo.
Si se sospecha que la persona es zurda se obtendrá el cuerpo de escritura tanto con la mano derecha como con la izquierda.
[Bloque 79: #a5-9]
1. Si el documento dubitado presenta varias firmas, se especificará cuáles son las firmas dubitadas y a qué persona/s supuestamente se le ha podido falsificar y/o manipular.
a) En primer lugar se procederá a la demostración de la autenticidad de la firma dubitada, para ello, se recogerán y enviarán el mayor número de firmas indubitadas de la víctima y firmas indubitadas espontáneas del sospechoso, como las del DNI, pasaporte, etc. En ambos casos y a ser posible coetáneas a la firma que se investiga.
b) Se obtendrá un cuerpo de escritura del sospechoso, que firmará en hojas en blanco, diez veces seguidas. A continuación, tras una pausa de unos minutos, en otro papel diferente se le dictará un pequeño texto, 50 palabras, en el que aparezcan las letras de la firma dubitada, seguido de otras diez firmas.
2. Si se tratará de un talón o documento mercantil, deben obtenerse las firmas sobre copias de documentos semejantes, que previamente debe rellenar el propio firmante. El número mínimo de estos documentos será de diez.
3. En el caso de que se sospechara una imitación, se le indicará al sospechoso que rellene y firme los documentos con el nombre de la víctima. Nunca se mostrará la firma dubitada.
4. Se preguntará, tanto a la víctima, como al sospechoso, si poseen distintos tipos de firmas, de ser así realizarán un cuerpo de escritura de todas ellas, en las mismas condiciones antes mencionadas.
[Bloque 80: #a5-10]
1. Anónimo realizado en letras mayúsculas o letras de imprenta:
Se dictará al sospechoso, cinco veces el texto de los anónimos, dictando al principio lentamente, para ir aumentando la velocidad de modo progresivo. Se seguirán las normas establecidas para el dictado.
Se dictará un pequeño texto, 25 palabras, compuesto por palabras del escrito anónimo, que debe así mismo escribirse con mayúsculas o letras de imprenta, según esté realizado el documento dubitado.
Se recogerán, si es posible, escritos indubitados existentes de la misma época de la que datan los anónimos.
2. Anónimo realizado con escritura normal o disfrazada:
Se dictará cinco veces al sospechoso el texto de los anónimos. Se dictará un texto más o menos largo, según el nivel cultural del sospechoso, de aproximadamente 25 palabras.
Se recogerán, si es posible, escritos indubitados existentes de la misma época de la que datan los anónimos.
[Bloque 81: #a5-11]
Se recogerán documentos indubitados realizados con el equipo sospechoso, de fechas anteriores, coetáneas y posteriores a la del documento dubitado.
Se imprimirá con el equipo sospechoso un texto, sello, logotipo, etc. idénticos al que figura en el documento dubitado.
Si el documento dubitado es una fotocopia, se enviarán diez fotocopias realizadas en un folio en blanco, indicando en cada fotocopia la fecha en que se ha realizado.
No se podrán enviar los documentos impresos en bolsas de plástico.
[Bloque 82: #dd]
Queda derogada la Orden de 8 de noviembre de 1996, por la que se aprueban las normas para la preparación y remisión de muestras objeto de análisis por el Instituto de Toxicología.
[Bloque 83: #df]
La presente orden se dicta al amparo de lo dispuesto en el artículo 149.1.5.ª de la Constitución, que atribuye al Estado la competencia exclusiva en materia de Administración de Justicia.
[Bloque 84: #df-2]
Se autoriza a la Dirección General de Relaciones con la Administración de Justicia para modificar, mediante resolución, los anexos que se acompañan a la presente orden.
[Bloque 85: #df-3]
La presente orden entrará en vigor el día siguiente al de su publicación en el «Boletín Oficial del Estado».
[Bloque 86: #fi]
Madrid, 13 de mayo de 2010.–El Ministro de Justicia, Francisco Caamaño Domínguez.
[Bloque 87: #ai]






Códigos de tipos de asunto y de estudios solicitados
|
Código |
Tipo de asunto |
|---|---|
|
DCPATRI. |
Delitos contra el patrimonio. |
|
DCLSEX. |
Delitos contra la libertad sexual. |
|
DCSALUDP. |
Delitos contra la salud pública. |
|
DCSVIAL. |
Delitos contra la seguridad del tráfico. |
|
DCMEDAMB. |
Delitos contra el medio ambiente. |
|
DINTOX. |
Diagnóstico de intoxicación/consumo de drogas. |
|
FALS. |
Falsedad / Falsificación. |
|
FILIA. |
Filiación. |
|
GARCAL. |
Garantía de calidad. |
|
LESION. |
Lesiones. |
|
MSUBITA. |
Muerte súbita. |
|
MSOSCRIM. |
Muerte sospechosa de criminalidad. |
|
MVIOL. |
Muerte violenta. |
|
RESPROF. |
Responsabilidades en el ámbito profesional. |
|
VICMULT. |
Suceso con víctimas múltiples. |
|
ESTUDIOS TOXICOLÓGICOS. |
|
|
ITVHOMI. |
Investigación toxicológica en víctimas de homicidio. |
|
ITSSUI. |
Investigación toxicológica ante la sospecha de suicidio (precipitación ahorcamiento..). |
|
ITMEXPTOX. |
Investigación toxicológica en muertes por presumible exposición a tóxicos. |
|
ITRAD. |
Investigación toxicológica ante la sospecha de reacción adversa a drogas de abuso. |
|
ITACCID. |
Investigación toxicológica en muertes por accidente de tráfico, laboral, deportivo.. |
|
ITSCRIM. |
Investigación toxicológica en muertes de etiología desconocida sospechosa de criminalidad. |
|
ITSOSPE. |
Investigación toxicológica sobre un sospechoso/detenido/procesado. |
|
ITDLSEX. |
Investigación toxicológica en delitos contra la libertad sexual. |
|
ITDSALUDP. |
Investigación toxicológica en delitos contra la salud pública. |
|
ITDSVIAL. |
Investigación toxicológica en delitos e infracciones contra la seguridad de tráfico. |
|
ITVARIOS. |
Investigación toxicológica de sustancias y productos varios. |
|
ITFAUNA. |
Investigación toxicológica en la fauna. |
|
ITCARBON. |
Investigación de acelerantes de la combustión y sobre cadáveres carbonizados. |
|
ITEXPLO. |
Investigación de explosivos. |
|
KVITREO. |
Data de la muerte a partir de iones en humor vítreo. |
|
ESTUDIOS BIOLÓGICOS. |
|
|
IDIBESCENA. |
Identificación de indicios biológicos de interés criminal en el lugar de los hechos. |
|
IDIBCUERPO. |
Identificación de indicios biológicos procedentes del cuerpo de la víctima y/o sospechoso. |
|
IDIBDLSEX. |
Identificación de indicios biológicos en casos de agresión sexual. |
|
IDGENCLIN. |
Identificación genética de muestras clínicas. |
|
FILIAPATVIV. |
Filiación en presencia del presunto padre/madre. |
|
FILIARFETAL. |
Filiación de restos fetales. |
|
FILIAPRENAT. |
Filiación prenatal. |
|
FILIAPATMUE. |
Filiación a partir de restos cadavéricos del padre/madre fallecido. |
|
FILIAANTEM. |
Filiación a partir de muestras biológicas antemortem del padre/madre fallecido. |
|
FILIAFAMMUE. |
Filiación a partir de familiares directos del padre/madre fallecido. |
|
IDRCADPATER. |
Identificación de restos cadavéricos mediante estudio de paternidad/maternidad. |
|
IDRCADANTEM. |
Identificación de restos cadavéricos por cotejo con muestras biológicas del fallecido. |
|
IDRCADFAM. |
Identificación de restos cadavéricos mediante análisis de familiares. |
|
SUMERSION. |
Estudio de diatomeas e hidremia en sospecha de muerte por sumersión. |
|
EBIOQUIMI. |
Estudios bioquímicos en casos de muertes súbitas e intoxicaciones. |
|
MICROBIO. |
Estudios microbiológicos en casos de muerte de etiología no aclarada. |
|
IBOTANICA. |
Estudios de identificación botánica en casos de intoxicación. |
|
ENTOMO. |
Data de la muerte a partir de estudios entomológicos. |
| HMSUBITA. | Investigación de muertes súbitas e inesperadas. |
| HTRAUMA. | Estudio de Lesiones/Traumatismos. |
| HVITALIDAD. | Estudio de vitalidad. |
| HASFIXIA. |
Estudio de asfixias mecánicas. |
| HMVIOLENRN. | Estudio de la muerte violenta del recién nacido |
| HINTOX. |
Patología de intoxicaciones. |
| HMDROGA. | Patología de muertes de drogadictos. |
| HANAFILAXIA. | Diagnóstico de anafilaxia. |
| HIATROGENIA. |
Investigación de iatrogenia. |
| HCITOLIQUI. | Estudio citológico de líquidos. |
|
ESTUDIOS CRIMINALÍSTICOS. |
|
|
MORFOPEL. |
Estudio de Indicios-Estudio morfológico de pelos. |
|
COTEPEL. |
Estudio de Indicios-Cotejo entre pelos dubitado e indubitados. |
|
GENEPEL. |
Estudio de Indicios-Selección de pelos que han de ser analizados con técnicas moleculares. |
|
COTEFIBRAS. |
Estudio de Indicios-Identificación y cotejo de fibras y cuerdas. |
|
OMPOPINT. |
Estudio de Indicios-Identificación del origen de la pintura. |
|
COTEPINT. |
Estudio de Indicios-Cotejo entre muestras dubitadas e indubitadas de pintura. |
|
COTETIERRA. |
Estudio de Indicios-Cotejo entre muestras dubitadas e indubitadas de tierra. |
|
COTEVIDRIO. |
Estudio de Indicios-Cotejo entre muestras dubitadas e indubitadas de vidrio. |
|
DETIDEXPLO. |
Estudio de Indicios-Detección e identificación de explosivos. |
|
IDALIMEN. |
Estudio de Indicios-Identificación de los alimentos en contenido gástrico y bronquial. |
|
DATAALIMEN. |
Estudio de Indicios-Determinación del tiempo de digestión en contenido gástrico. |
|
HUEDACTIL. |
Estudio de Indicios-Revelado de huellas dactilares y otras impresiones. |
|
INDIVARIOS. |
Estudio de Indicios-Varios. |
|
TIPOHERIDA. |
Estudio de heridas-Determinación del tipo de herida (incisa, punzante, contusa etc.). |
|
OBJEVULNE. |
Estudio de heridas por arma blanca u objetos contundentes-Características del objeto vulnerante. |
|
LAZOSURCO. |
Estudio de surcos de ahorcadura-Compatibilidad entre lazo y surco. |
|
CORTECOR. |
Estudio de heridas en cordón umbilical-Mecanismo de corte del extremo libre del cordón. |
|
ORIDISPA. |
Estudio de heridas por arma de fuego-Diagnóstico diferencial entre orificio de entrada de salida. |
|
DISTADISPA. |
Estudio de heridas por arma de fuego-Determinación de la distancia de disparo. |
|
RESIDISPA. |
Investigación de residuos de disparo en manos y/o ropas. |
|
VIOLENROPA. |
Investigación de signos de violencia en ropas-Determinación de la causa de las soluciones de continuidad. |
|
RESTOSEO. |
Estudios antropológicos-Estudios identificativos de restos óseos y dentarios. |
|
RADIOLO. |
Estudios antropológicos-Estudio de radiografías con fines identificativos y de edad del sujeto. |
|
DOCIMPRE. |
Documentoscopia y Grafística-Estudio de documentos impresos. |
|
DOCMANU. |
Documentoscopia y Grafística-Estudio de documentos manuscritos. |
|
ESTUDIOS MEDIOAMBIENTALES, DE INCENDIOS Y FAUNA. |
|
|
VERAGUARES. |
Estudio de afectación medioambiental por vertidos de aguas residuales urbanas o industriales. |
|
VERPURDEPU. |
Estudio de afectación medioambiental por vertidos de purines y lodos de depuradora. |
|
RESILIXI. |
Análisis y Valoración Toxicológica de Residuos y Lixiviados. |
|
SUELOS. |
Análisis y Valoración Toxicológica de contaminantes en suelos. |
|
VERPETROL. |
Estudio de afectación medioambiental por vertidos de petróleo y derivados. |
|
ENSAYOECO. |
Ensayos de ecotoxicidad. |
|
VENEFAUNA. |
Estudio de envenenamientos de la fauna. |
|
EUTROFIZA. |
Estudio de parámetros de eutrofización. |
|
INCENDIO. |
Estudio de la afectación medioambiental por incendios en el área urbana y en el área rural. |
|
VALORINFOAM. |
Valoración de Informes medioambientales. |
Redactado conforme a la corrección de errores publicada en BOE núm. 146, de 16 de junio de 2010. Ref. BOE-A-2010-9507
[Bloque 88: #ai-2]

Este documento es de carácter informativo y no tiene valor jurídico.
Ayúdenos a mejorar: puede dirigir sus comentarios y sugerencias a nuestro Servicio de atención al ciudadano
Agencia Estatal Boletín Oficial del Estado
Avda. de Manoteras, 54 - 28050 Madrid