 Este texto consolidado es de carácter informativo y no tiene valor jurídico.
Este texto consolidado es de carácter informativo y no tiene valor jurídico.[Bloque 1: #preambulo]
En la primordial misión de velar por la salud pública, que por el Gobierno, a través del Ministerio de Sanidad y Seguridad Social, se lleva a cabo, se destaca el interés de efectuar un adecuado control de las sustancias psicotrópicas. Ello, porque la acción de las mismas ofrece efectos que aconsejan vigilancia y cuidado en el uso que de ellas se haga con fines terapéuticos, y más aún en la prevención de las repercusiones sanitarias que de su utilización no apropiada o indebida puedan derivarse.
De acuerdo con estas finalidades, que a las diferentes naciones merecen asimismo semejante atención, se acordaron medidas de carácter internacional plasmadas en el convenio sobre sustancias psicotrópicas de Viena» el veintiuno de febrero de mil novecientos setenta y uno, suscrito por nuestro país.
Procede, por consiguiente, en el marco de las razones aludidas dentro del espíritu y propósitos de dicho Convenio, establecer las normas que den cauce adecuado a los diversos aspectos y problemas que plantean las repetidas sustancias, bien consideradas por sí solas, bien en cuanto a los preparados (especialidades farmacéuticas y/o fórmulas magistrales) en que las mismas se incluyan.
Se determinan, pues, diferenciadamente, las condiciones y reglas a que estarán sujetas al respecto las diversas personas o entidades que forman el ciclo completo a controlar tocante a las sustancias psicotrópicas, comenzando por su fabricación y continuando por la elaboración de especialidades farmacéuticas que las contengan, la distribución, la prescripción y la dispensación de éstos, así como contemplar las posibilidades y requisitos de importación o exportación de unas y otros.
Se previenen que los aludidos preparados habrán de prescribirse en receta médica con los datos e información precisos para la ejecución y comprobación correcta de las dispensaciones.
En su virtud, a propuesta del Ministro de Sanidad y Seguridad Social y previa deliberación del Consejo de Ministros en su reunión del día seis de octubre de mil novecientos setenta y siete.
DISPONGO:
[Bloque 2: #i]
[Bloque 3: #aprimero]
Uno. Las sustancias psicotrópicas a que se refieren las Listas I, II, III y IV del anexo uno y la «Relación de sustancias no incluidas en dichas Listas» del anexo dos, a que se refiere el artículo quinto, o bien que en futuro puedan ser incorporadas a las Listas o la Relación, así como los preparados (especialidades farmacéuticas o fórmulas magistrales) que las contengan, quedan sometidos a cuanto se previene en la presente disposición.
Dos. Sin perjuicio de lo establecido en el párrafo precedente, la Dirección General de Ordenación Farmacéutica, en caso de surgir dudas, determinará cuándo una especialidad farmacéutica debe ser o no considerada entre las sometidas a lo que en este Decreto se ordena, así como las medidas de tal sujeción, de acuerdo con lo previsto en el mismo.
[Bloque 4: #asegundo]
Uno. Quedan prohibidos, incluso a los efectos de la Ley de Contrabando, el uso, la fabricación, importación, exportación, tránsito, comercio, distribución y tenencia, así como la inclusión en todo preparado de las sustancias incluidas en la Lista I.
Dos. No obstante, si se pretendiera utilizar las sustancias de dicha Lista I para fines científicos, se habrá de solicitar concretada y detalladamente, en caso caso, de la Dirección General de Ordenación Farmacéutica, la cual, cuando lo estime oportuno, dará autorización para ello, especificando las normas de control procedentes.
[Bloque 5: #atercero]
Uno. Si en un mismo preparado o especialidad farmacéutica estuviesen asociadas sustancias incluidas en más de una de las mencionadas Listas II, III y IV, se entenderá aquél sujeto a las condiciones y requisitos establecidos para los incluidos en la lista que reciba tratamiento más riguroso en la presente disposición.
[Bloque 6: #acuarto]
Uno. La Dirección General de Ordenación Farmacéutica, mediante Resolución, podrá modificar el contenido de la Lista de principios activos contenidos en el anexo dos, así como los formatos y exigencias de los libros e impresos cuyos modelos figuran también como anexos, en el presente Decreto.
Dos. Dicho Centro directivo dictará las disposiciones o adoptará las decisiones convenientes para el establecimiento del Registro, tanto de fabricantes como de entidades de distribución que se indican en los artículos sexto y catorce, respectivamente, así como para adecuar la situación de las especialidades farmacéuticas que sean o no incluibles en lo que se señala en el presente Decreto.
[Bloque 7: #ii]
[Bloque 8: #aquinto]
Uno. Las sustancias psicotrópicas no consignadas en las Listas I, II, III y IV del anexo uno, pero sí en la «Relación de sustancias psicotrópicas no incluidas en dichas Listas» cuya relación aparece como anexo número dos del presente Decreto, así como los preparados que contengan estas últimas, estarán exentos de las normas de esta disposición, salvo en lo previsto en los articulas trece y dieciséis en cuanto a símbolos y receta a cuyos artículos se hallaran sujetos.
[Bloque 9: #iii]
[Bloque 10: #asexto]
Uno. Las personas naturales o jurídicas que se dediquen o pretendan dedicarse a la fabricación de cualquier sustancia consignada en las Listas II, III y IV del anexo uno deberán estar autorizadas e inscritas –así como su Director Técnico responsable–, para la continuación o, previamente, para el comienzo de dicha fabricación en un registro que a tal efecto se establecerá en los correspondientes servicios farmacéuticos de Control de estupefacientes y psicotrópicos de la Dirección General de Ordenación Farmacéutica. Las autorizaciones a que se refiere este artículo no afectarán a las que correspondan al Ministerio de Industria y Energía.
[Bloque 11: #aseptimo]
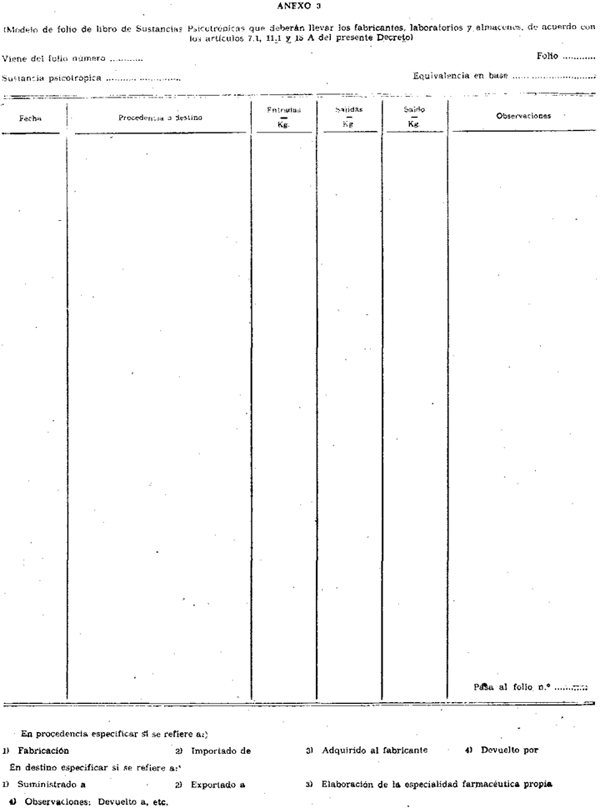
Uno. Los citados fabricantes llevarán un libro de contabilidad de entrada, salida y existencias de todas las referidas sustancias que elaboren, importen o exporten. Aquel libro constará de folios numerados correlativamente en los que se contendrán los epígrafes que se indican en el modelo que, con el número tres, ligará como anexo a la presente disposición.
Dos. El libro de contabilidad se presentará por el interesado fabricante, antes de que comience a ser usado, a la Inspección Provincial de Farmacia respectiva, para que aquél sea diligenciado en la contraportada, así como sellado en todos sus folios.
Tres. Dentro del libro, y en sus folios, no se dejarán espacios o renglones en blanco. En el comienzo del libro se abrirá un folio para cada una de las sustancias que el fabricante elabore. Cuando resulte necesario, se consignará al pie de cada folio el número del nuevo folio en que los asientos continúan, y así sucesivamente. No se mezclarán las anotaciones o asientos de las respectivas sustancias, de manera que pueda seguirse sin lugar a equivocación sustancia por sustancia, todas las entradas y salidas, así como el balance de éstas en cualquier momento.
[Bloque 12: #aoctavo]
Uno. Por parte de los aludidos fabricantes no podrá hacerse entrega de aquellas sustancias psicotrópicas más que a las personas o entidades autorizadas para la fabricación, utilización o tráfico de las mismas, bien para exportación, según previene este Decreto. Dicha entrega se efectuará siempre contra recepción de vale fechado, extendido por cualquiera de tales peticionarios. Habrá de solicitarse un vale por cada uno de las sustancias psicotrópicas entregadas. Los vales, que deberán conservarse durante el plazo de dos años, los archivará el fabricante, formando con ellos grupos diferenciados, une por cada sustancia que produzca, de forma que pueda comprobarse la correspondencia entre el asiento de salida en el libro antes mencionado y el vale que lo ampara. El referido vale será impreso por la Dirección General de Ordenación Farmacéutica.
Dos. El fabricante igualmente, archivará, por grupos referidos a cada sustancia psicotrópica, en la forma y con la finalidad expresada en el párrafo uno precedente, las autorizaciones de importación o exportación de las referidas sustancias que, en su caso, le hayan sido otorgadas por la Dirección General de Ordenación Farmacéutica, de acuerdo con lo establecido en el artículo diez. Del mismo modo, dichas autorizaciones deberán conservarse durante el plazo de dos años.
[Bloque 13: #anoveno]
Los fabricantes estarán obligados a remitir anualmente a los correspondientes servicios farmacéuticos del Control de Estupefacientes y Psicotrópicos de la Dirección General de Ordenación Farmacéutica, y por conducto de la Inspección Provincial de Farmacia respectiva, un parte por duplicado, en el que se especifique, por cada sustancia psicotrópica, los totales de las entradas y salidas de la misma habidas durante el año, así como las existencias de ellas el treinta y uno de diciembre de dicho año. La Inspección Provincial de Farmacia conservará el duplicado y remitirá el original a los mentados Servicios, dentro del mes de enero siguiente. Se redactarán los partes en los impresos cuyo modelo se incluye como anexo de esta disposición bajo el número cuatro.
Dichos fabricantes quedan sometidos a la Inspección por los Servicios Centrales y Provinciales de Farmacia, dependientes de la Dirección General de Ordenación Farmacéutica, independientemente del sometimiento que deban tener a las Inspecciones de otros Organismos de la Administración.
[Bloque 14: #iv]
[Bloque 15: #adecimo]
Uno. La importación o exportación de cualquiera de las sustancias incluidas en las Listas II, III o IV del anexo uno, requerirá autorización previa de la Dirección General de Ordenación Farmacéutica.
Dos. Asimismo, la importación o exportación de especialidades farmacéuticas que contengan sustancias psicotrópicas consignadas en aquellas Listas se verificarán previa autorización de dicho Centro directivo, que la otorgará con arreglo a las exigencias legales en vigor, respecto a tales importación o exportación de especialidades.
Tres. Por lo que se hace a datos a requerir o impresos para formalizar la tramitación de las importaciones y exportaciones, tanto de las referidas sustancias psicotrópicas como de las especialidades farmacéuticas en que se incluyan las mismas, la Dirección General de Ordenación Farmacéutica dará las instrucciones o tomará las medidas que juzgue oportunas.
[Bloque 16: #v]
[Bloque 17: #aundecimo]
Uno. Los laboratorios llevarán dos libros de contabilidad de entrada, salida y existencias por una parte de las repetidas sustancias de las listas (I, III y/o IV, y, por otra, de las especialidades farmacéuticas que elaboran con cualquiera de dichas sustancias. No se registrarán en el libro, sin embargo, aquellas especialidades que, no obstante con tener alguna o algunas de tales sustancias, hayan sido declaradas por la Dirección General de Ordenación Farmacéutica, con arreglo al artículo primero, dos, exentas de las normas propias de la presente disposición. Sin perjuicio de lo anteriormente establecido, los laboratorios quedarán obligados a acreditar a la Dirección General de Ordenación Farmacéutica, cuando ésta lo solicite, justificantes relacionados con la fabricación y destino de dichas especialidades.
Dos. El formato, formalidades de diligencia y sellado, y entretenimiento del libro se verificarán de la misma manera que se previene en el artículo séptimo. Ahora bien, los epígrafes de que constarán los folios del libro serán los que se reseñan en los modelos que aparecen anexos a la presente disposición con los números tres y cinco.
Tres. Por lo que respecta a los partes que anualmente deberán remitir a la Dirección General de Ordenación Farmacéutica, los laboratorios cumplirán los requisitos establecidos en el artículo noveno de esta disposición.
[Bloque 18: #aduodecimo]
En cuanto a las sustancias de las Listas II, III o IV, por una parte, así como a las especialidades farmacéuticas que las contengan, por otra, los laboratorios se regirán por lo determinado, respectivamente, en los apartados A) y B) que siguen.
A) Sustancias psicotrópicas referidas.
Los laboratorios sólo podrán hacer uso de ellas, bien para elaboración de las especialidades farmacéuticas de las que sean titulares, bien para exportación o bien para venta o entrega a las personas autorizadas a utilizarlas según este Decreto, y siempre mediante los vales o documentos para cada caso prevenidos en el mismo, unos y otros, de los cuales habrá de ser objeto igualmente de su respectivo archivo, en la forma señalada en el artículo octavo. De modo paralelo, la obtención de las sustancias repetidas se hará por los laboratorios, exclusivamente, de las aludidas personas o entidades o bien a través de importación, con sometimiento en todo caso a las reglas que al efecto se prescriben y también con el archivo correspondiente de los documentos que fundamentan tales operaciones.
B) Especialidades farmacéuticas que contengan las citadas sustancias psicotrópicas.
Los laboratorios solamente las entregarán a los almacenes farmacéuticos o a las Oficinas de Farmacia, mediante los oportunos vales. También podrán destinarlos a exportación, según el artículo décimo. En cualquier supuesto, el archivo de los correspondientes documentos de salida se efectuarán respectivamente, en la forma determinada en el artículo octavo.
[Bloque 19: #vi]
[Bloque 20: #adecimotercero]
Las especialidades farmacéuticas que, por incluir cualquiera de las sustancias psicotrópicas se hallen sujetas, según el artículo primero-uno, a las normas de la presente disposición, llevarán un símbolo en la parte superior derecha de cada una de las caras principales del cartonaje y en el prospecto. Dicho símbolo servirá para identificar de inmediato y fácilmente su naturaleza.
En el caso de que las sustancias psicotrópicas pertenezcan a las Listas II, III o IV del anexo uno, el símbolo será un disco mitad negro mitad blanco, y para las especialidades farmacéuticas con sustancias de la Lista del anexo dos, el mismo será un círculo atravesado por un diámetro vertical. En ambos casos de acuerdo con el modelo que se inserta en el anexo número seis.
[Bloque 21: #vii]
[Bloque 22: #adecimocuarto]
Las personas naturales o jurídicas que se dediquen o pretendan dedicarse al tráfico de cualquier sustancia consignada en las listas II, III y IV anexas deberán estar autorizadas o inscritas –salvo en los casos en que por cualquier otro motivo, concepto, ya lo estuvieran–, así como su Director Técnico, responsable, para la continuación o, previamente, para el comienzo de dicho tráfico, en un registro que a tal efecto se establecerá en los correspondientes servicios farmacéuticos de control de estupefacientes y psicotrópicos de la Dirección General de Ordenación Farmacéutica.
[Bloque 23: #adecimoquinto]
En cuanto a las sustancias de las Listas II, III o IV del anexo uno por una parte, así como a las especialidades farmacéuticas que las contengan, por otra, las entidades de distribución se regirán por lo determinado, respectivamente, en los apartados A) y B) que siguen:
A) Sustancias psicotrópicas referidas.
Las entidades de distribución las obtendrán sólo de cualquiera de las personas o entidades autorizadas en este Decreto, o a través de importación. La entrega de las mismas las harán exclusivamente a personas o entidades asimismo autorizadas, o con destino a exportación. Todo ello, siempre mediante entrega o recepción de vales, o de permisos de importación o exportación, de acuerdo con lo dispuesto en los artículos octavo y décimo. Los vales o los permisos se archivarán con arreglo a las normas respectivas prescritas en el citado artículo octavo. Deberán llevar, asimismo, las entidades de distribución, el libro de contabilidad implantado en el artículo séptimo, cuyo entretenimiento se efectuará bajo las mismas formalidades en él determinadas, y en relación, igualmente, con el archivo de aquellos documentos.
B) Especialidades farmacéuticas que contengan las aludidas sustancias psicotrópicas.
Las entidades de distribución o almacenes farmacéuticos, autorizados por la Dirección General de Ordenación Farmacéutica, según Orden de siete de abril de mil novecientos sesenta y cuatro, recibirán las especialidades farmacéuticas únicamente de quienes estén autorizados para su producción o tráfico según el presente Decreto, o a través de importación. Las entregas las verificarán sólo a aquellos, o bien por conducto de exportación, mediante entrega o recepción de vales análogos a los mencionados en el artículo octavo, o bien mediante permiso de importación o exportación, de acuerdo con lo prevenido en el artículo décimo. No habrán de llevar obligadamente estas entidades de distribución libro de contabilidad de especialidades, como en el caso de los laboratorios farmacéuticos, pero los referidos documentos serán archivados por grupos, clasificados éstos por especialidades de manera que, en cualquier momento, pueda justificarse cumplidamente ante los Inspectores Farmacéuticos el destino, existencias y saldos de cada una de tales especialidades.
[Bloque 24: #viii]
[Bloque 25: #adecimosexto]
Respecto de las sustancias de las Listas II, III y IV del anexo uno, las Oficinas de Farmacia cumplirán lo que se determina en el apartado A) de este artículo.
En cuanto a las especialidades farmacéuticas que contengan sustancias psicotrópicas de dichas listas II, III y IV, así como de la «Relación de sustancias psicotrópicas no incluidas en tales Listas» a que se refiere el artículo quinto, seguirán las normas del apartado B) y C)siguiente, así como las establecidas en particular para la dispensación, tanto en el artículo decimoséptimo como en lo dispuesto por Orden ministerial de fecha once de mayo de mil novecientos setenta y siete.
A) Sustancias de las consignadas en las listas II, III y IV (anexo uno).
Respecto a ellas, las farmacias las obtendrán sólo de cualquiera de las personas o entidades autorizadas en este Decreto, mediante entrega previa de vales o de permisos de importación, de acuerdo con lo dispuesto en los artículos octavo y décimo. Su salida o dispensación sólo podrá efectuarse mediante prescripción de fórmula magistral solicitada en receta médica con los requisitos exigidos en el artículo decimoséptimo y en lo dispuesto por Orden ministerial de fecha once de mayo de mil novecientas setenta y siete. La contabilidad se llevará en el libro de estupefacientes.
B) Especialidades farmacéuticas que contengan sustancias de las Listas II, III y IV (anexo uno).
Las obtendrán sólo de cualquiera de las personas o entidades autorizadas en este Decreto, mediante entrega previa de vales.
Su salida o dispensación sólo podrá efectuarse mediante presentación de receta médica, con los requisitos exigidos tanto en el artículo decimoséptimo como en lo dispuesto por Orden ministerial de fecha once de mayo de mil novecientos setenta y siete.
No será preciso llevar libro de contabilidad, pero sí su anotación en el libro recetario, así como archivar las recetas por grupos, al igual que lo indicado para los vales de salida de almacenes en el artículo decimoquinto, salvo en los casos que sea imposible su archivo.
C) Sustancias y especialidades farmacéuticas que las contengan, de la mencionada «Relación de sustancias psicotrópicas no incluidas en las Listas II, III y IV (anexo dos).
Para su adquisición no se necesitará la entrega de vales ni se llevará libro de contabilidad, pero sí su anotación en el libro recetario, así como la obligación de exigir receta médica para su dispensación, de acuerdo con lo dispuesto en la Orden ministerial de fecha once de mayo de mil novecientos setenta y siete
[Bloque 26: #adecimoseptimo]
Uno. Los preparados (especialidades farmacéuticas o fórmulas magistrales) que contengan sustancias de las Listas II, III y IV, así como de la «Relación de sustancias psicotrópicas no incluidas en dichas listas» a que alude el artículo quinto, se prescribirán en receta médica.
Las recetas de los preparados (especialidades farmacéuticas o fórmulas magistrales) que contengan sustancias de las Listas II, III y IV que queden archivadas en las Oficinas de Farmacia, permanecerán en las mismas durante el plazo de dos años.
Dos. Los preparados (especialidades farmacéuticas o fórmulas magistrales) que contengan sustancias en las Listas II, III y IV, además de cumplir con lo dispuesto por Orden ministerial de fecha once de mayo de mil novecientos setenta y siete, habrán de cumplir en su prescripción y para su dispensación los siguientes requisitos en la receta médica:
a) La prescripción en caso de fórmulas magistrales en cada receta médica no podrá superar a un tratamiento máximo de diez días, por consiguiente, el farmacéutico no podrá dispensar mayor cantidad, salvo ratificación expresa del facultativo, en su caso, en la propia receta médica.
Si se tratara de especialidades farmacéuticas, sólo podrá dispensarse un ejemplar por receta.
b) No deberán prescribirse en una misma receta médica otros preparados junto con los que contengan sustancias de dichas Listas.
[Bloque 27: #ix]
[Bloque 28: #adecimoctavo]
Se consideran faltas leves las contravenciones a lo preceptuado en la presente disposición que no se hayan consignado entre las graves o muy graves.
[Bloque 29: #adecimonoveno]
Se reputarán como faltas graves las siguientes:
Uno. La reincidencia en una misma falta leve.
Dos. No llevar los libros, los partes, los vales y demás documentos oficiales para la contabilidad, control y tráfico de las sustancias y preparados psicotrópicos, así como el archivo de aquellos para los que así está preceptuado en la presente disposición.
Tres. Vender, suministrar y, en su caso, adquirir sustancias psicotrópicas y preparados elaborados con éstas entidades y personas no autorizadas para ello por la presente disposición.
Cuatro. La omisión de símbolos y demás datos de consignación obligatoria en materiales de acondicionamiento, tanto interiores como exteriores.
Cinco. No dar cuenta a la Dirección General de Ordenación Farmacéutica o no contar con el permiso de la misma en lo que se refiere a traslados de instalaciones de fabricación y de otras actividades de las empresas y establecimientos sometidos por esta disposición.
Seis. Importar y exportar sustancias y especialidades farmacéuticas reguladas por esta disposición sin el correspondiente permiso específico, para tales actos, otorgado por la Dirección General de Ordenación Farmacéutica.
Siete. La prescripción y/o dispensación sin receta o en receta que no reúna las condiciones establecidas en la Orden ministerial de once de mayo de mil novecientos setenta y siete y las establecidas en esta disposición.
[Bloque 30: #avigesimo]
Se conceptuarán como faltas muy graves las siguientes:
Uno. La reincidencia en una misma falta grave.
Dos. Fabricar, importar, exportar, adquirir, poseer o almacenar, vender o suministrar y distribuir sustancias psicotrópicas y especialidades farmacéuticas preparadas con éstas, sin estar autorizadas e inscritas en cada caso por la presente disposición.
Tres. El incumplimiento de lo dispuesto en el artículo segundo con respecto a las sustancias consignadas en la Lista uno.
Cuatro. Cuando una falta grave de las enumeradas anteriormente haya causado perjuicio para la salud pública.
[Bloque 31: #avigesimoprimero]
Las faltas leves se castigarán con las siguientes sanciones:
Uno. Apercibimiento.
Dos. Multas de cinco mil a cincuenta mil pesetas.
[Bloque 32: #avigesimosegundo]
Las faltas graves se sancionarán:
Uno. Multas de cincuenta mil a quinientas mil pesetas.
Dos. En los supuestos tres y cuatro del artículo decimonoveno de las faltas graves podrá acordarse la suspensión de fabricación, venta o suministro de sustancias psicotrópicas por espacio de dos meses a un año.
Tres. En los supuestos tres y cuatro del artículo decimonoveno de las faltas graves, además de las sanciones indicadas implicará la retirada del mercado de los ejemplares existentes por el laboratorio respectivo, y el decomiso si se trata de sustancias psicotrópicas.
[Bloque 33: #avigesimotercero]
Las faltas muy graves se castigarán con:
Uno. Multas de quinientas mil a cinco millones de pesetas.
[Bloque 34: #avigesimocuarto]
Corresponde a la Dirección General de Ordenación Farmacéutica y al Ministerio de Sanidad y Seguridad Social la imposición de sanciones a toda persona natural o jurídica que infrinja lo dispuesto en la presente disposición.
Uno. Las sanciones por faltas leves y graves serán impuestos por la Dirección General de Ordenación Farmacéutica.
Dos. Las sanciones por faltas muy graves hasta un millón de pesetas serán impuestas por el Ministerio de Sanidad y Seguridad Social, y las superiores a dicha cantidad, por acuerdo del Consejo de Ministros.
[Bloque 35: #avigesimoquinto]
El procedimiento sancionador se ajustará a los trámites previstos en la legislación general de Procedimiento Administrativo y será independiente de las que puedan surgir por otras jurisdicciones o tribunales.
[Bloque 36: #primera]
Por el Ministerio de Sanidad y Seguridad Social se dictarán las disposiciones complementarias precisas para el desarrollo del presente Decreto, al objeto de que por las entidades y empresas a quienes afecte, puedan acomodarse y adecuarse a su normativa.
[Bloque 37: #firma]
Dado en Madrid a seis de octubre de mil novecientos setenta y siete.
JUAN CARLOS
El Ministro de Sanidad y Seguridad Social,
ENRIQUE SÁNCHEZ DE LEÓN PÉREZ
[Bloque 38: #an1]
|
Denominación común internacional |
Otras denominaciones comunes o triviales |
Denominación química |
|---|---|---|
|
Sustancias de la lista I |
||
|
1 |
DET. |
N, N-dietiltriptamina. |
|
2 |
DMHP. |
3-(1,2-dimetilheptil)-1-hidroxi - 7.8,9,10-tetrahidro-6,6,9-tirimetil-ell-dibenzo(b,d) pirano. |
|
3 |
DMT. |
M, N-dimetiltriptamina. |
|
4 ( )-Lisérgida. |
LSD, LSD-25. |
(+)-N, N-dietilisergamida (idietilamida del ácido dlisérgico). |
|
5 |
Mescalina. |
3,4,5-trimetoxifenetilamina. |
|
6 |
Parahexilo. |
3-hoxil-1-hidroxi -7,8,9,10 - tetrahidro - 6,6,9- trimetil-6H-dibenzo (b,d)pirano. |
|
7 |
Psilocina, psilotsina. |
3-(2-dimetilaminoetil)-4-hidroxi-indol. |
|
8 Psilocibina. |
|
Fosfato dihidrogenado de 3-(2-dimetil-aminoetil) indol-4-ilo. |
|
9 |
STP-DOM. |
2-amino-1-(2,5-dimetoxi 4-metil) fenilpropano. |
|
10 |
Tetrahidrocannabinoles, todos los isómeros. |
1-hidroxi-3-pentil-6a, 7,10,10a-tetrahidro-6,6,9 trimetil - 6H - dibenzo (b, d) pirano. |
|
Sustancias de la lista II |
||
|
1 Anfetamina. |
|
( )-2-amino-1-fenilpropano. |
|
2 Dexanfetamina. |
|
( )-2-amino-1-fenilpropano. |
|
3 Metanfetamina. |
|
( )-2-metilamino-1-fenilpropano. |
|
4 Metilfenidato. |
|
Ester metílico del ácido 2-fenil-2-(2-piperidil) acético. |
|
5 Fenciclidina. |
|
1-(1-fenilciclohexil)-piperidina. |
|
6 Fenmetracina. |
|
3-metil-2-fenilmorfolina. |
|
Sustancias de la lista III |
||
|
1 Amobardital. |
|
Ácido 55-etil-5-(3-metilbutil) barbitúrico. |
|
2 Ciclobardital. |
|
Ácido 5-(19-ciclohexen-l il) 5 etilbarbitúrico. |
|
3 Giutetimida. |
|
2-etil-2-fenilglutarimida. |
|
4 Pentobarbital. |
|
Ácido 5-etil-5-(1-metilbutil) barbitúrico. |
|
5 Secobarbital. |
|
Ácido 5-alil-5-(1-metilbutil) barbitúrico. |
|
Sustancias de la lista IV |
||
|
1 Anfepramona. |
|
2-(dietilamino)-propiofenona. |
|
2 Barbital. |
|
Ácido 5,3-dietilbarbitúrico. |
|
3 |
Etclorvinol. |
Etil-2-cloroviniletinil-carbinol. |
|
4 Etinamato. |
|
Carbamato de 1-etinilciclohexanol. |
|
5 Meprobamato. |
|
Dicarbamato de 2-metil-2-propil-1-3-propanodiol. |
|
6 Metacualona. |
|
2-metil-2-o-tolil-4(3H)-quinazolinona. |
|
7 Metilfenobarbital. |
|
Ácido 5-etil-1-metil-5-fenilbarbitúrico. |
|
8 Metiprilona. |
|
3,3-dietil-5-metil-2,4-piperidinodiona. |
|
9 Fenobarbital. |
|
Ácido 5-etil-5-fenilbarbitúrico. |
|
10 Pipradrol. |
|
1,1-fifenil-1-(2-peperidi) metanol. |
|
11 |
SPA. |
(-)-1-dimetiIamino-1,2-difeniletano. |
Véase el apartado 1 de la Orden de 27 de febrero de 1992 Ref. BOE-A-1992-6246, en relación a la exclusión de sustancias de la lista I, y el apartado 1 de la Orden de 27 de febrero de 1992 Ref. BOE-A-1992-6247, en relación con la transferencia de determinadas sustancias de la lista I a la lista II.
Téngase en cuenta para su aplicación los apartados 2 y 3 de ambas Órdenes.
Véanse los apartados 1.1 y 2 de la Orden de 19 de octubre de 1990 Ref. BOE-A-1990-26177, en relación a la inclusión de sustancias en las listas I y IV.
Téngase en cuenta para su aplicación los apartados 1.2, 3, 4 y 5.
Véase el apartado 1 de la Orden de 20 de diciembre de 1988 Ref. BOE-A-1989-543, en relación a la inclusión de sustancias en la lista II, y el art. 1 de la Orden de 28 de septiembre de 1989 Ref. BOE-A-1989-23803, en relación a la inclusión de sustancias en la lista III.
Téngase en cuenta para su aplicación los apartados 2 a 4 de la Orden de 20 de diciembre y arts. 2 a 4 de la Orden de 28 de septiembre de 1989.
Véanse los apartados 1 y 2 de la Orden de 6 de octubre de 1987 Ref. BOE-A-1987-24340, en relación a la inclusión de sustancias en las listas III y IV.
Téngase en cuenta para su aplicación los apartados 2 a 4.
Véanse los apartados 1 a 3 de la Orden de 30 de mayo de 1986 Ref. BOE-A-1986-14543, en relación a la inclusión de sustancias en las listas I, II, III y IV.
Téngase en cuenta para su aplicación los apartados 4 a 6.
Véase el apartado 1 de la Orden de 12 de julio de 1985 Ref. BOE-A-1985-15521, en relación a la inclusión de sustancias en la lista I.
Véanse los apartados 1 de las Órdenes de 30 de mayo de 1984 Ref. BOE-A-1984-12894 y Ref. BOE-A-1984-12895, en relación a la inclusión de sustancias en las listas III y IV.
Ténganse en cuenta para su aplicación los apartados 2 a 4.
[Bloque 39: #an2]
|
Denominación común internacional |
Otras denominaciones comunes o triviales |
Denominación química |
|---|---|---|
|
Acetilbarbromal. |
|
Acetil-3-(2 bromo-2-etilbutiril) urea. |
|
Agac. |
Complejo de Cloral con N Acetil Glicenamida. |
|
|
Aponeurón. |
|
N-(α-metilfeniletil)-2-fenilgIicino-nitrilo. |
|
Aprobarbital. |
|
Ácido 5-alil-5-isopropil-barbitúrico. |
|
Bromisovalum. |
|
α-bromisovalerilurea |
|
Butalilonal. |
|
5-(2-bromoalil)-5- (secbutil) barbitúrico. |
|
Carbocloral. |
|
|
|
Carbromal. |
|
2-bromo-2 etilbutililurea. |
|
Cardubard |
|
Ácido 5-butil-5(2-carbamoiloxietil) barbitúrico. |
|
Ciclopento Barbital. |
|
Ácido 5-alil-5(2-ciclopentin-1-il)-barbitúrico |
|
Clobenzorex. |
|
ClH-(cloro bencil)α-metil fenilamina. |
|
Cloralsalicilamina. |
|
|
|
Cloralodol. |
Clorexadol. |
|
|
Cloranbetaina. |
|
|
|
Clorfentermina. |
|
p-cloro α-α dimetil-feniletilamina. |
|
Clortermina. |
|
o-cloro α-α dimetil-feniletilamina. |
|
Dicloralfenazona. |
|
|
|
Dimebamato |
|
2-2-dimetil-1,3-propanodiol dicarbamato. |
|
Ebubamato. |
|
2-etil-2N-butil-1,3-propanodiol dicarbamato. |
|
Emilcamato. |
|
1-etil-1-metilpropil-carbamato. |
|
Etilanfetamina. |
|
N-etil-α-metil feniletilamina. |
|
Fenalineal. |
Alfonal. |
Ácido 5-alil-5-fenil barbitúrico. |
|
Fenglentavimida. |
|
α-fenil α (β-dietil-aminoetil-glutarimidal) |
|
Fenpentadiol. |
|
2-(p.clorofenil)-4-metil pentano 2-4-diol). |
|
Fenaglicodol. |
|
(2-p-clorofenil-3-metil-2-3-butandiol). |
|
Heptabarbital. |
|
Ácido 5-(1-cilohepten-1-il)-5-etil barbitúrico. |
|
Hexapropimato. |
|
1-(2-propinil cilohexilcarbamato). |
|
Hexobarbital. |
|
Ácido 5(1-cilohen-1-il) 1,5,dimetil-barbitúrico |
|
Hexetal. |
|
Ácido 5 (etil-5-N-hexil-barbitúrico) (sal sódica). |
|
Hidrato de Cloral. |
|
|
|
Hidroximeprobamato. |
|
2-metil-2(2-hidroxipropil)-1,3 propanodiol dicarbamato. |
|
Malasín. |
|
Ácido 1-1-ciclobexil-2-metilamino, propano fenil etil barbitúrico. |
|
Mefentermina. |
|
N-α-α-trimetiIfeniletilamina. |
|
Metaglicodol. |
|
(2-m clorofenil-3-metil 2,3-butandiol). |
|
Metilpentinol. |
|
3-metilpent-1-in-3-ol |
|
Metilpentinolcarbamato. |
|
3-metilpent-1-in-3-ol carbamato |
|
Nealbarbital. |
|
Ácido 5-alil-5 (neopentilobarbitúrico). |
|
Nisobamato. |
|
2-secbutil.N-isopropil-2-metil 1,3-propanodiol dicarbamato. |
|
Nitracepato potásico. |
|
Sal potásica del ácido-7-nitro-2,3-dihidro-2 oxo-5-fenil-1H-1,4-benzodiazepin-3 carboxílico |
|
Ortetamina. |
|
2-metiI-4,2-metilfenil etilamina. |
|
Pentabamato. |
|
1,2,3- trimetil 1,3-propanodiol-dicarbamato. |
|
Pentorex. |
|
α-α,β-trimetil feniletilamina |
|
Pontricloral. |
|
|
|
Propalilonal. |
|
Ácido 5-(bromoalil-5-isopropil barbitúrico). |
|
Talbutal |
|
Ácido 5-alil-5-(secbutil) barbitúrico |
|
Tibamato. |
|
N-butil-2 metil-2-propil-1,3-propanodiol dicarbamato. |
|
Triclofos. |
|
|
|
Vinbarbital. |
|
5-etil-5 (1-metil-1butenil) barbitúrico ácido |
Se modifica por el apartado 3 de la Orden de 30 de mayo de 1986 Ref. BOE-A-1986-14543
Téngase en cuenta para su aplicación los apartados 4 a 6.
Se modifica por el apartado 1 de la Orden de 22 de julio de 1983 Ref. BOE-A-1983-21200.
Ténganse en cuenta para su aplicación el apartado 2.
[Bloque 40: #an3]
[Bloque 41: #an4]

[Bloque 42: #an5]

[Bloque 43: #an6]

Este documento es de carácter informativo y no tiene valor jurídico.
Ayúdenos a mejorar: puede dirigir sus comentarios y sugerencias a nuestro Servicio de atención al ciudadano
Agencia Estatal Boletín Oficial del Estado
Avda. de Manoteras, 54 - 28050 Madrid